
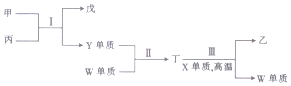
| A. | 原子半径:X<Y<Z | |
| B. | 反应Ⅰ中丙既能做氧化剂又作还原剂 | |
| C. | 非金属性:X>Y>W | |
| D. | 反应Ⅱ和Ⅲ反应均属于置换反应 |
分析 X、Y、Z、W为原子序数依次递增的短周期主族元素,X、Y两元素的原子最外层电子数之和为10,且X、Y可形成两种气态化合物甲和乙,可知X为C、Y为O;Y、Z能形成一种具有强氧化性的淡黄色固体化合物丙,丙为Na2O2;结合图中转化可知,甲为CO2,Y为O2,戊为Na2CO3,乙为CO;W与X位于同一主族,W为Si,再结合图中转化可知,丁为SiO2,结合原子序数可知,Z为Na,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Na,W为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Y<X<Z,故A错误;
B.丙为Na2O2,I中过氧化钠与二氧化碳反应生成碳酸钠和氧气,只有过氧化钠中O元素的化合价变化,则反应Ⅰ中丙既能做氧化剂又作还原剂,故B正确;
C.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:Y>X>W,故C错误;
D.反应Ⅱ为化合反应,反应Ⅲ反应属于置换反应,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、原子序数、元素的位置来推断元素是解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0,下列叙述正确的是
H++ OH- ΔH > 0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
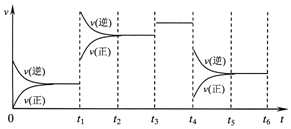 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )| A. | t1时升高了温度 | B. | t3时加入了催化剂 | ||
| C. | t5~t6时刻,Y转化率最小 | D. | 在t3~t4时间内,X的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇能发生取代反应和加成反应 | |
| B. | 1mol 3-(2-噻吩)丙烯酸(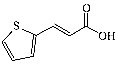 )发生加成反应时最多消耗3mol H2 )发生加成反应时最多消耗3mol H2 | |
| C. | 淀粉和纤维素的分子通式均为(C6H10O5)n,故淀粉和纤维素互为同分异构体 | |
| D. | 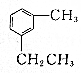 与 与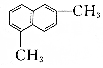 都属于芳香烃,二者互为同系物 都属于芳香烃,二者互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com