
| A. | 1L0.1mol•L-1NH4Cl溶液中,NH4+的数量为0.1NA | |
| B. | 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA | |
| D. | 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA |
分析 A.铵根易水解;
B.Mg与H2SO4反应生成Mg2+,故1molMg参与反应转移2mol电子;
C.标准状况下,22.4L任何气体所含的分子数为1mol;
D.H2+I2=2HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA
解答 解:A.铵根易水解,所含NH4+数小于0.1NA,故A错误;
B.n(Mg)=$\frac{2.4g}{24g/mol}$=0.1mol,Mg与H2SO4反应生成Mg2+,则1molMg参与反应转移2mol电子,故0.1molMg参与反应转移0.2mol电子,即0.2NA,故B错误;
C.标准状况下,22.4L任何气体所含的分子数为1mol,故2.24LN2和O2的混合气体中分子数为0.1mol,即0.1NA,故C错误;
D.H2+I2=2HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA,故选D.
点评 本题考查了阿伏伽德罗常数的应用,题目难度不大,注意气体摩尔体积指的是1mol任何气体的体积为22.4L.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀HNO3中加入过量铁粉,再滴入少量KSCN溶液 | 溶液变红 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 0.1mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 50mL12mol•L-1的盐酸与足量MnO2共热,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | B. | S2-的结构示意图: | ||
| C. | 过氧化氢的电子式:H+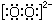 H+ H+ | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的简单氢化物的热稳定性比W强 | |
| B. | Y的简单离子与X的具有相同的电子层结构 | |
| C. | Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红 | |
| D. | Z与X属于同一主族,与Y属于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O
+H2O →
→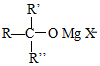 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$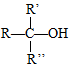

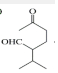 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$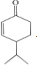 +H2O.
+H2O.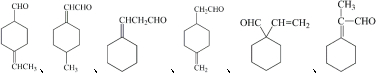
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13. .
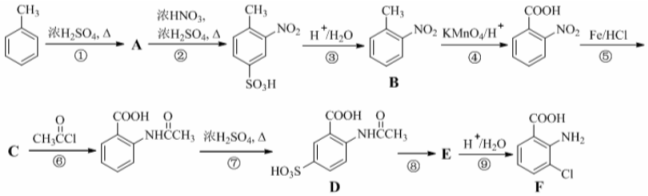
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基.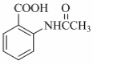 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.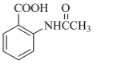 …$→_{反应条件}^{反应试剂}$目标化合物 …$→_{反应条件}^{反应试剂}$目标化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com