
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )

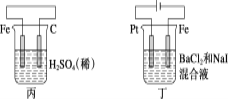
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
【答案】C
【解析】
由图可知:甲图为原电池,其中Zn为负极,失去电子,生成Zn2+;乙图为电解池,银与电源的正极相连接,为阳极,发生氧化反应;丙图为原电池,铁作负极,失去电子发生氧化反应,电解液中的H+得到电子,发生还原反应;丁图为电解池,铁与电源的负极相连,为阴极,Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应。
A. 甲图中Zn为负极,失去电子,生成Zn2+,电极反应式为:Zn-2e-= Zn2+,A项错误;
B. 乙图中银与电源的正极相连接,为阳极,发生氧化反应。乙中阳极反应式为Ag-e-=Ag+,B项错误;
C. 丙中铁作负极,失去电子发生氧化反应,电解液中的H+得到电子向正极移动,即H+向碳棒方向移动,C项正确;
D. 丁图中Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应,D项错误;
答案选C。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】现有原子序数递增的X、Y、Z、W四种常见元素。其中X元素基态原子核外电子占据了三个能级,且每个能级上的电子数相等;Y原子的p轨道处于半充满状态,Z的单质是空气的主要成分之一;W在周期表中位于ds区,且与Z可形成化学式为W2Z或WZ的二元化合物。请回答下列问题:
⑴W元素原子核外电子运动状态有_____种,该元素基态离子W+的电子排布式为___________。
⑵元素X、Y和Z的第一电离能由大到小顺序为__________(填元素符号)。
⑶Y2Z与XZ2具有相同的结构特征,其理由是__________。
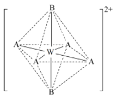
⑷X、Y和Z均可形成多种氢化物,写出一种X的氢化物分子结构中σ键和π键数目之比3∶2的结构式______;A、B分别是Y、Z的最简单氢化合物,A的空间构型为_______,其中Y原子的杂化轨道类型为______;W2+与A、B分子结合成配合离子[WA4B2]2+结构如下图,该配合离子加热时首先失去的组分是_____(填“A”或“B”)。
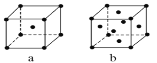
⑸元素W的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,假定不同温度下元素W原子半径不变,且相邻最近原子间距为原子半径之和,则其体心立方堆积与面心立方堆积的两种晶体密度之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组同学用如图1装置进行实验,试回答下列问题:
①若开关K与a连接,则铁发生电化学腐蚀中的______腐蚀,石墨电极上的电极反应式为______.

②若开关K与b连接,则电解反应的化学方程式为______.
(2)该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如2图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
①该电解槽的阳极反应式为______.此时通过阴离子交换膜的离子数______(选填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH______(选填“增大”、“不变”或“减小”).
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为______;已知H2的燃烧热为285.8KJ/mol,则该燃料电池工作产生36g液态H2O时,理论上有______kJ的能量转化为电能.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g)![]() B(g) ΔH>0在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的
B(g) ΔH>0在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
B.在该温度恒压条件下再充入少量B气体,则a=b
C.若其他条件不变,升高温度,则a<b
D.若保持温度、压强不变,充入惰性气体,则a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ/mol
(1)若某反应的平衡常数表达式为K=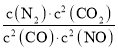 ,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)____________。
,请写出此反应的热化学方程式:_______;下列措施能够增大此反应中NO的转化率的是(填字母代号)____________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_____。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=____________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11,水的离子积常数Kw=1×10-14)
NH3·H2O+H2CO3的平衡常数K=____________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11,水的离子积常数Kw=1×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
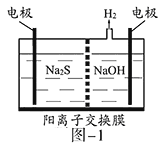
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
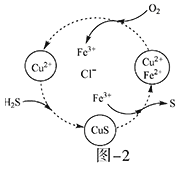
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________。
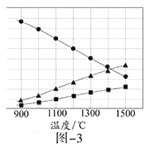
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是

A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我国学者研发的高效过氧化氢一尿素电池的原理装置:
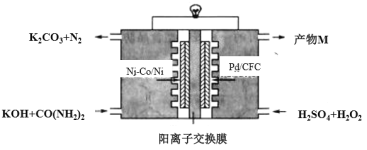
该装置工作时,下列说法错误的是
A.Ni-Co/Ni极上的电势比Pd/CFC极上的低
B.向正极迁移的主要是K+,产物M主要为K2SO4
C.负极反应为:CO(NH2)2+8OH–-6e–=CO32–+N2↑+6H2O
D.Pd/CFC极上发生反应:H2O2+2e–=2OH–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com