
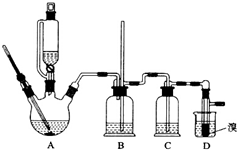
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
分析 装置A是乙醇在浓硫酸的存在下在170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致市场的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,二氧化碳、二氧化硫能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,
(1)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(2)浓硫酸具有强氧化性,可能氧化乙醇中的碳;
(3)乙烯和溴水发生了加成反应;
(4)根据1,2-二溴乙烷和水的密度相对大小解答;
(5)Br2可以和氢氧化钠发生氧化还原反应;
(6)利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
(7)溴易挥发,该反应放热;
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,
故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,
故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,
故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案为:下;
(5)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:b;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 该题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol•L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
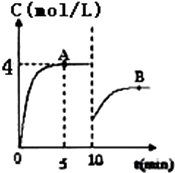 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Ca2+、K+、Cl- | D. | NO3-、K+、ClO-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸溶液反应 2Fe+6H+═2Fe2++6H2↑ | |
| B. | 醋酸和小苏打溶液反应 CH3COOH+HCO3-═CH3COO-+H2O+CO2↑ | |
| C. | 二氧化碳和少量烧碱溶液反应 CO2+2OH-═CO32-+H2O | |
| D. | 氯化亚铁和氯气反应生成氯化铁 Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com