
| A. | 碳酸氢铵和硝酸铵 | B. | 碳酸铵和硝酸铵 | ||
| C. | 碳酸氢铵和氯化铵 | D. | 碳酸铵和氯化铵 |
分析 假设13.2故全部为硫酸铵,其物质的量为$\frac{13.2g}{132g/mol}$=0.1mol,根据N元素守恒可知生成氨气为0.2mol,标况下氨气的体积为0.2mol×22.4L/mol=4.48L>4.3L,故杂质中铵根离子的含量小于硫酸铵,再结合选项判断.
解答 解:假设13.2故全部为硫酸铵,其物质的量为$\frac{13.2g}{132g/mol}$=0.1mol,根据N元素守恒可知生成氨气为0.2mol,标况下氨气的体积为0.2mol×22.4L/mol=4.48L>4.3L,故杂质中铵根离子的含量小于硫酸铵,硫酸铵中m(NH4+):m(SO42-)=18:48,
A.碳酸氢铵中m(NH4+):m(HCO3-)=18:61,硝酸铵中m(NH4+):m(NO3-)=18:62,则混合物中铵根离子含量小于硫酸铵,可能含有,故A不选;
B.碳酸铵中m(NH4+):m(CO32-)=18:30,硝酸铵中m(NH4+):m(NO3-)=18:62,则混合物中铵根离子含量可能小于硫酸铵,可能含有,故B不选;
C.氯化铵中m(NH4+):m(Cl-)=18:35.5,碳酸氢铵中m(NH4+):m(HCO3-)=18:61,则混合物中铵根离子含量可能小于硫酸铵,可能含有,故C不选;
D.氯化铵中m(NH4+):m(Cl-)=18:35.5,碳酸铵中m(NH4+):m(CO32-)=18:30,则混合物中铵根离子含量一定大于硫酸铵,不可能含有,故D选;
故选D.
点评 本题考查混合物的计算,难度中等,注意利用假设法进行解答,注意对化学式中元素或原子团质量分数的理解与灵活应用,试题培养了学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水所含分子数目为NA | |
| B. | 常温常压下,23g NO2和23g N2O4所含原子数目均为1.5NA | |
| C. | 标准状况下,22.4L氦气(He)与22.4L氟气(F2)所含原子数均为2NA | |
| D. | 18g D2O所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
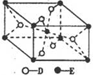 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.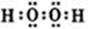 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com