
【题目】在一定条件下,某些不饱和烃分子之间可以进行自身的加成反应,如:CH≡CH+CH≡CH→CH≡C-CH=CH2,现有有机物甲,其结构式为: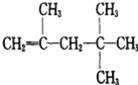 ,它是由不饱和烃乙的两个分子在一定条件下发生自身加成而得,在此反应中,除获得甲外,同时还获得了另一产物丙,丙是甲的同分异构体,则:乙的结构简式为________,丙的结构简式为_________。
,它是由不饱和烃乙的两个分子在一定条件下发生自身加成而得,在此反应中,除获得甲外,同时还获得了另一产物丙,丙是甲的同分异构体,则:乙的结构简式为________,丙的结构简式为_________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还蕴藏着丰富的矿产,海水中含有大量的化学物质,是宝贵的化学资源。海水素有“液体工业原料”的美誉,可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质。下面是海水综合利用的部分流程:

完成下列问题:
(1)下列说法错误的是________(填标号)。
A.电解饱和食盐水时阳极的电极反应式为:Cl2+2e-===2Cl-
B.苦卤制溴过程一定发生氧化还原反应
C.操作Ⅰ是蒸发结晶
D.E物质可以循环使用
(2)沉淀剂A来源于石灰窑厂,写出A的化学式:A_______________。
(3)实验室提纯粗盐的实验操作依次为:取样、________、沉淀、过滤、________。
(4)工业生产纯碱的工艺流程中,碳酸化时产生的现象为___________,发生反应的化学方程式是____________,其原因是______________。
(5)碳酸化后过滤,滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是___________。向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是________(填标号),这样做可使原料氯化钠的利用率从70%提高到90%以上。
a.增大NH![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)用加热分解的方法测定产品纯碱的纯度,若取m1 g纯碱样品,实验结束后称得固体质量为m2 g,则纯碱的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂,其合成方法为: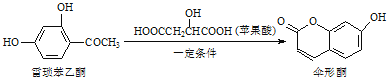 ,下列有关这三种物质的说法正确的是( )
,下列有关这三种物质的说法正确的是( )
A. 每个雷琐苯乙酮、苹果酸和伞形酮分子中均含有1个手性碳原子
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗3molH2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列关于该有机物的说法正确的是
![]()
①分子式为 C16H14O5 ;②能使酸性 KMnO4 溶液褪色;③能发生加成反应,但不能发生取代反应;④苯环上的一溴代物有6种;⑤1mol该有机物水解时最多能消耗4molNaOH;⑥1mol该有机物在一定条件下和 H2 反应,共消耗 6molH2。
A.①②③⑥B.①②⑤C.①④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第 VIII 族元素,跟主族元素的金属相比,它们有熔、沸点高、硬度高、密度大等特点,并有良好的延展性和高导电、导热性。下列有关它们及其化合物的结构与性质,请填写:
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为________,提供孤对电子的成键原子是________。
(2)①Co元素形成CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)各1mol,分别与足量硝酸银溶液反应,都得到1molAgCl沉淀。两种配合物中配合离子的配位数都是________,CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的组成相同而颜色不同的原因是________。
②Co(OH)2为两性氢氧化物,在浓的强碱溶液中可以形成[Co(OH)4]2。写出Co(OH)2酸式电离的电离方程式__________。
(3)与 Co 属于同周期同族的过渡元素A,其基态原子排布中有四个未成对电子。
①由此元素可构成固体X,区别X为晶体或非晶体的方法为______________。
②A可与CO反应生成A(CO) 5 ,常压下熔点为-20.3℃,沸点为103.6℃,该晶体类型是______________。
③A3+与SCN不仅能以1:3的个数比配合,还可以其它个数比配合。若 A3+与SCN以1:4 的个数比配合,则ACl3与KSCN在水溶液中发生反应的化学方程式可表示为_______。
④A 可与另两种元素B、C构成某种化合物,B、C的外围电子排布分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为_________。
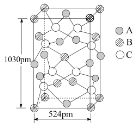
该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=__________g﹒cm3。(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
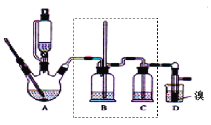
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
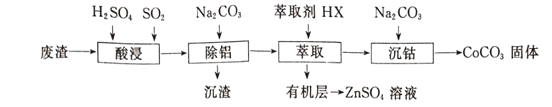
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com