
| 核外电子排布的特点 | 元 素 符 号 |
| (1)最外层电子数为2的原子 | |
| (2)次外层电子数是最外层电子数2倍的原子 | |
| (3)最外层电子数是次外层电子数3倍的原子 | |
| (4)原子核内无中子的原子 |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
| A、绿矾久存,表面变黄褐色:4(FeSO4?7H2O)+O2=4Fe(OH)SO4+26H2O |
| B、不能用玻璃塞试剂瓶盛放强碱性溶液:SiO2+2OH-=SiO32-+H2O |
| C、淡黄色的过氧化钠粉末久存,表面变白:2Na2O2=2Na2O+O2 |
| D、长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
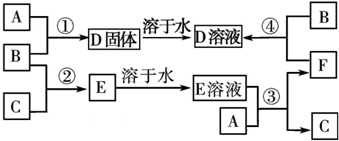
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们的电子层数依次增多 |
| B、单质的活泼性依次减弱 |
| C、它们的氢化物的稳定性依次增强 |
| D、单质的颜色依次加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com