
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
分析 将0.04 mol/L的HCl溶液与0.08 mol/L的NaHS溶液等体积混合HCl量不足,根据反应HCl+NaHS═H2S+NaCl,NaHS剩余一半,又因为是两份溶液等体积混合,所以溶液中NaHS、NaCl、H2S三者的物质的量浓度均为0.02 mol/L,其中的c(Na+)=0.04 mol/L,c(Cl-)=0.02 mol/L,由所得溶液的pH<7,说明等浓度的H2S的电离程度大于NaHS水解,c(HS-)>0.02 mol/L,所以离子浓度关系c(Na+)>c(HS-)>c(Cl-)>c(H+)>c(OH-);然后结合电荷守恒、物料守恒进行解答.
解答 解:A.因为HCl量不足,根据反应HCl+NaHS═H2S+NaCl,NaHS剩余一半,又因为是两份溶液等体积混合,所以溶液中NaHS、NaCl、H2S三者的物质的量浓度均为0.02 mol/L,其中的c(Na+)=0.04 mol/L,c(Cl-)=0.02 mol/L,由所得溶液的pH<7,说明等浓度的H2S的电离程度大于NaHS水解,c(HS-)>0.02 mol/L,所以离子浓度关系c(Na+)>c(HS-)>c(Cl-)>c(H+)>c(OH-),故A错误;
B.电荷守恒关系应为:c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-)+2c(S2-),故B错误;
C.由物料守恒可得c(HS-)+c(H2S)+c(S2-)=0.04 mol/L=c(Na+),故C错误;
D.物料守恒代入电荷守恒,并把c(Cl-)=0.02 mol/L代入数值可得:c(H+)-c(OH-)=0.02-c(H2S)+c(S2-),故D正确;
故选D.
点评 本题考查溶液中离子浓度大小比较、物料守恒、电荷守恒以及质子守恒,题目难度中等,物质混合体系的离子浓度问题解决思路应该是首先书写化学反应方程式,然后判断是否完全,进而明确组成溶液的各成分以及浓度关系,试题培养了学生的分析能力及灵活应用能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:填空题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
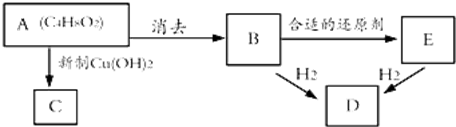
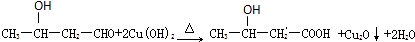 .
.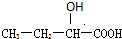 、
、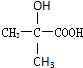 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
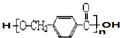 其合成路线如下:
其合成路线如下: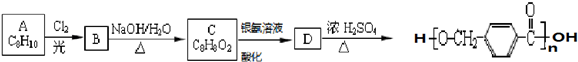
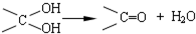
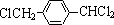 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.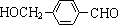 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$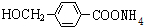 +2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n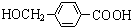 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$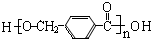 +(n-1)H2O.
+(n-1)H2O.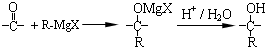
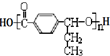 ,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 含有相同官能团,且相对分子量相差14的有机物一定互为同系物 | |
| D. | 互为同系物的有机物,其化学性质相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com