
����Ŀ����ҵ�����������������������ȡ������ú�����Fe2+��Fe3+������������Һ�����ȵ�һ���¶ȣ����裬����һ�������������Һ����������Һ������Һ�����ɻ��Զ������̣�������Һ��pH����Ӧһ��ʱ�䣬Fe��OH�� 3�Ͷ������̷��������������ã����յõ��������������壮 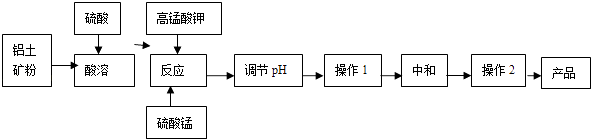
��1��KMnO4���Ƚ�Fe2+����ΪFe3+ �� �䱾������ԭΪMnO2 �� ��Ӧ�����ӷ���ʽΪ ��
��2��д�����������Һ����������Һ��Ӧ�Ļ�ѧ����ʽ �� ʵ��֤����n��MnO2��/n��Fe��������4��1ʱ������Ч���Ϻã�����Һ���������Ӻ�������Ũ�Ⱦ�Ϊ0.03mol/L��Ϊ�ﵽ�Ϻõij���Ч����ÿ1L��ҺӦ���������ص����ʵ���Ϊ ��
��3������pH�������� ��
��4������1������Ϊ �� ����2������Ϊ ��
���𰸡�
��1��MnO4��+3Fe2++4H+=3Fe3++MnO2+2H2O
��2��2KMnO4+3MnSO4+2H2O=5MnO2��+K2SO4+2H2SO4��0.102mol
��3��ʹ������ת��Ϊ��������������ȥ
��4�����ˣ�����Ũ������ȴ�ᾧ������ϴ��
���������⣺��1��KMnO4���Ƚ�Fe2+����ΪFe3+ �� �䱾������ԭΪMnO2 �� ����ԭ���غ�͵���غ���д���ӷ���ʽΪ��MnO4��+3Fe2++4H+=3Fe3++MnO2+2H2O�����Դ��ǣ�MnO4��+3Fe2++4H+=3Fe3++MnO2+2H2O����2���������֪���������Һ����������Һ��Ӧ���ɻ��Զ������̣�����������ԭ��Ӧ�л��ϼ�������ȣ���д����ѧ����ʽΪ2KMnO4+3MnSO4+2H2O=5MnO2��+K2SO4+2H2SO4 �� ����Һ���������Ӻ�������Ũ�Ⱦ�Ϊ0.03mol/L����Һ�к���Fe2+���ʵ���Ϊ0.03mol��������ҺPHʹ������ȫ��������n��Fe��=0.06mol
MnO4��+ | 3Fe2++4H+=3Fe3++ | MnO2+2H2O |
0.01mol | 0.03mol | 0.01mol |
n��MnO2��/n��Fe��������4��1ʱ������Ч���Ϻã���n��MnO2��=0.06mol��4=0.24mol��
��Ӧ�����ɶ����������ʵ���=0.24mol��0.01mol=0.23mol�����ĸ���������ʵ�����
2KMnO4+3MnSO4+2H2O= | 5MnO2��+K2SO4+2H2SO4 �� |
2 | 5 |
n | 0.23mol |
n=0.092mol��
Ϊ�ﵽ�Ϻõij���Ч����ÿ1L��ҺӦ���������ص����ʵ���=0.092mol+0.01mol=0102mol��
���Դ��ǣ�2KMnO4+3MnSO4+2H2O=5MnO2��+K2SO4+2H2SO4��0.102mol����3������������ˮ�ⷴӦ����������������������ҺPH��ʹ��ҺPH����ʱ����ʹ������ת��Ϊ��������������ȥ�����Դ��ǣ�ʹ������ת��Ϊ��������������ȥ����4������������Ϣ����Ӧһ��ʱ�䣬�������̺�Fe ��OH�� 3���������������ã���֪����1Ϊ���ˣ�����2Ϊ���˺���Һ����Ũ������ȴ�ᾧ������ϴ�ӣ�
���Դ��ǣ����ˣ�����Ũ������ȴ�ᾧ������ϴ�ӣ�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ϩ���壬����ȥ��ϩ��ѡ�õ��Լ��ǣ� ��
A.����������Һ
B.���Ը��������Һ
C.��ˮ
D.̼������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в�����Ӫ�����ʵ���(����)
A. ������B. ������C. ��֬D. �Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��KI����������Һ�м������������Һ��Ѹ�ٷ�Ӧ�ų��������ݣ���Һ����ɫ��
��������֪����Ӧ�������£�
��H2O2+2KI+H2SO4=I2+K2SO4+2H2O��
��H2O2+I2=2HIO�� ��H2O2+2HIO=I2+O2��+2H2O
��1����˫���ŷ���ʾ���̢ٵ���ת�������H2O2+2KI+H2SO4=I2+K2SO4+2H2O
��2������ʵ����̢�����У�I2���������ã�
��3�����жϣ�����������HIO��H2O2��O2�������������Ե�ǿ�������ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
A. SO2��Ħ������Ϊ64g
B. �����Ħ�����ԼΪ22.4L/mol
C. 12g12C������̼ԭ������Ϊ�����ӵ�����
D. 4gNaOH����1Lˮ������Һ�����ʵ���Ũ��Ϊ0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����գ�
��1���ڶ���������Ԫ���У��ȼ���������Ԫ�صĵ縺���ɴ�С��˳��������Ԫ�ط��ű�ʾ��
��2��A��B��CΪͬһ�����ڽ���Ԫ�أ������±����ݷ�����CԪ���ڻ������е���Ҫ���ϼ�Ϊ��A��B��C����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳���� ��
������/kJmol��1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
��3����֪����������ӵĿռ�ṹ��ͼ��ʾ�� 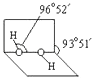 ��������ԭ�Ӳ�ȡ�ӻ���ͨ������£�H2O2��ˮ����Ȼ��ܵ���Ҫԭ���� ��
��������ԭ�Ӳ�ȡ�ӻ���ͨ������£�H2O2��ˮ����Ȼ��ܵ���Ҫԭ���� ��
��4��R��1��36��Ԫ����δ�ɶԵ���������ԭ�ӣ�R3+����Һ�д�������ת���� R3+ ![]() R��OH��3
R��OH��3 ![]() [R��OH��4]��
[R��OH��4]��
�ٻ�̬Rԭ�ӵļ۵����Ų�ʽΪ ��
��[R��OH��4]���д��ڵĻ�ѧ���� ��
A�����Ӽ� B�����Լ� C���Ǽ��Լ� D����λ��
��5���ȵ�����ԭ���ɹ�������Ϊ����ԭ������ȣ���ԭ��ָԭ��������4��ԭ�ӣ����ܵ�������۵�������ȵķ��ӻ����ӣ�����H2O2����Һ���У��ɵð�ɫ����A�����������ʾ��A���������������ӣ����������������壬��������H2O2��Ϊ�ȵ����壮��A�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ���
A.�ø������ֽ��о����ڻ�������
B.������ά�������˶��µIJ��ϣ���ˮ������ά
C.����������ά��ø������ά���������������ֽ�����
D.�ִ������ͨ���õ������ĺϽ�֣�������Ҫ�ɷ���̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ԭ�����м���������̿�ۣ���Ͼ��Ⱥ������ڱ���NaCl��Һ��ʪ���ľ�֧�Թ��У�������Ƥ���������Ӻ�ֹˮ�У��۲쵽������ˮ���������Դ˹��������ķ�����ȷ���ǣ�������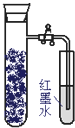
A.̼���ڵ绯ѧ��ʴ������������
B.̿�۱�����
C.������������ʴ
D.���������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������ձ��õ���������Pt��Cu��Zn��C�ֱ�Ϊ�ĸ��缫�����պϿ��غ�����������ȷ���ǣ�������
A.Cu������OH��Ũ������
B.Cu��Ϊԭ��ظ���
C.������������C������Pt��
D.��C������4mol����ת��ʱ��Pt������1mol O2����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com