
分析 Cu核外含有29个电子,据此书写;将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到四氨合铜络离子,溶液呈深蓝色,据此书写方程式.
解答 解:Cu核外含有29个电子,则外围电子排布式为3d104s1;
将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到[Cu(NH3)4]2+络离子,溶液呈深蓝色,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-;
故答案为:3d104s1;先产生蓝色沉淀,后逐渐溶解,得到深蓝色溶液;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++4H2O+2OH-.
点评 考查核外电子排布规律以及铜离子得性质等,难度不大,注意氨水逐滴加入硫酸铜溶液中的现象.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;钙离子的电子式为:Ca2+.
;钙离子的电子式为:Ca2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
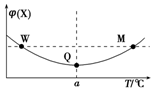 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数减小 | |
| B. | W、M两点Y的正反应速率相等 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | M点时,Y的转化率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和 | |
| C. | 加适量NH4Cl固体可使溶液由a点变到b点 | |
| D. | c、d两点代表的溶液中c(H+)与c(OH-)乘积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
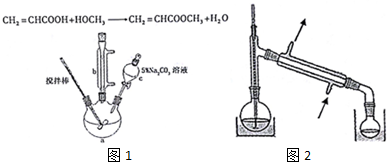
| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸丙烯酸甲酯 | 80.5℃ | 难溶于水易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL容量瓶配制70mL0.1mol/L盐酸 | |
| B. | 用托盘天平称取25.20g氯化钠 | |
| C. | 用20mL的量筒量取13.86mL NaOH溶液 | |
| D. | 用蒸发皿加热胆矾晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com