
 用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:
用0.1000mol/L NaOH溶液滴定待测H2SO4溶液:分析 (1)锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)若滴定到终点时不慎多滴了一滴NaOH溶液,即0.05mL,此时溶液体积为50mL,反应后溶液中c(OH-)=0.1mol.L-1×$\frac{0.05}{50}$=10-4mol.L-1,根据c(H+)c(OH-)=10-14计算c(H+),进而计算所得溶液的pH;
(5)先根据滴定管的精确度以及测量原理来求出消耗的NaOH溶液体积,再根据硫酸和NaOH反应2NaOH+H2SO4=Na2SO4+2H2O求出c(H2SO4).
解答 解:(1)盛放待测硫酸的锥形瓶下方垫一张白纸的作用是便于观察溶液颜色变化,准确判断滴定终点;
故答案为:便于观察溶液颜色变化,准确判断滴定终点;
(2)滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(3)①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准NaOH溶液,溶液被稀释,导致V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析则c(待测)偏大;
②用酸式滴定管取用待测液前,尖嘴部位有气泡,取用过程中气泡消失,待测液的物质的量偏小,导致V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析则c(待测)偏小;
③滴定前,读碱式滴定管内碱液体积时仰视液面,滴定后读碱液体积时,俯视液面,导致V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析则c(待测)偏小;
④锥形瓶未用待测液润洗,待测液的物质的量不变,导致标准液体积无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,则c(待测)不变;
故答案为:②③;①;
(4)若滴定到终点时不慎多滴了一滴NaOH溶液,即0.05mL,此时溶液体积为50mL,反应后溶液中c(OH-)=0.1mol.L-1×$\frac{0.05}{50}$=10-4mol.L-1,根据c(H+)c(OH-)=10-14,则c(H+)=10-10mol/L,所以pH=10,故答案为:10;
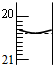
(5)碱式滴定管初读数为0.00mL,达到终点时读数为20.40mL,消耗的NaOH溶液体积为20.40mL,待测液体积为20.00mL
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.1000mol/L×20.40mL c(H2SO4)×20.00mL
解得c(H2SO4)=0.051mol/L
故答案为:0.051mol/L;
点评 本题主要考查了滴定操作、误差分析以及化学计算,难度不大,注意酸碱的混合计算中,抓住过量的计算.


科目:高中化学 来源: 题型:选择题
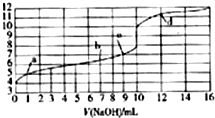
| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C5H12O的醇 | ||
| C. | 分子式为C5H10O2的羧酸 | D. | 分子式为C5H10O2的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
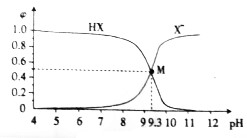
| A. | 25℃时,$\frac{c(HX)}{c({X}^{-})•c({H}^{+})}$=109.3 | |
| B. | M点溶液中存在:c(X-)+c(OH-)=c(H+)+c(Na+) | |
| C. | 滴加盐酸的过程中,水的电离程度先减小后增大 | |
| D. | 常温下,等浓度等体积的HX和NaX溶液混合后,溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
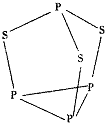 三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
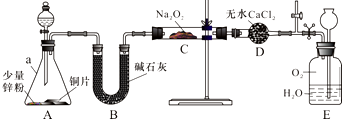 NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.
NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向相同体积,相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积,可以比较两种一元酸的酸性相对较弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至恰好不再有沉淀生成,再向其中滴加Na2S溶液,生成黑色沉淀,说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH,可以比较HClO和CH3COOH的酸性强弱 | |
| D. | 在滴有酚酞Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com