
【题目】下列物质的水溶液因水解而显碱性的是
A.NaClB.NaOHC.NH4ClD.CH3COONa
科目:高中化学 来源: 题型:
【题目】氯化钠、氢氧化钠、碳酸钠和碳酸氢钠是生活中常见的物质.请回答下列问题.
(1)等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者后者(填>、<或=).
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 .
(3)除去NaHCO3溶液中的少量Na2CO3 , 方法是: , 离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
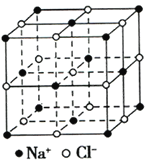
【题目】新型锂离子电池电解质锂盐二氟草酸硼酸锂[LiBF2(C2O4)]的合成方法如下:2H2C2O4+SiCl4+2LiBF4→2LiBF2(C2O4)+SiF4+4HCl
(1)与氯同族的第四周期元素原子的基态核外电子排布式为_______________________。
(2)草酸分子(乙二酸,H2C2O4)中碳原子轨道的杂化类型是_____________,1mol草酸分子中含有σ键的数目为____________。
(3)与SiF4互为等电子体的阴离子的化学式为__________。BF4-的空间构型为_____________。
(4)第一电离能介于B、F两种元素之间的第二周期元素有__________种。
(5)已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代,使化合物中Ni和O的比值发生了变化。某氧化镍样品组成为Ni0.93O,此晶体化学式为_______________________。(用含Ni2+、Ni3+表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的_____极,OH—向______(填“正”或“负”)极作定向移动,Y极的电极反应方程式为________,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是_______ L。
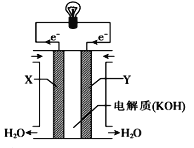
(2)为了验证Fe3 +与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是__________。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4 + 2H2O![]() Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
Pb + PbO2 + 2H2SO4。铅蓄电池放电时正极是______(填物质化学式),该电极质量_____(填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
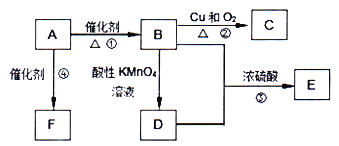
(1)A、D分子中的官能团分别名称为_______、_______。
(2)反应①的反应类型为________。
(3)反应②的化学方程式为_________。
(4)反应③的化学方程式为_______;该反应的反应类型为_____。
(5)反应④的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 根据右图对照试验实验1、2的现象可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol L-1 的盐酸和硫酸反应,后者更剧烈
B. 右图实验2中生成红色物质的离子方程式:Al+Cu2+=Al3++Cu
C. 探究FeCl3和KI溶液反应限度:将1mL0.1mol L-1 FeCl3溶液加入到5 mL 0.1mol L-1KI溶液中,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察现象
D. 水电离出的c(H+)=10-10 mol L-1的溶液:Na+、K+、Cl-、HCO3-可以共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.O2和O3互为同素异形体
B.乙醇(CH3CH2OH)和乙二醇(CH2OHCH2OH)互为同系物
C.氕、氘、氚互为同位素
D.甲烷的二氯代物结构只有一种的事实,可证明甲烷为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 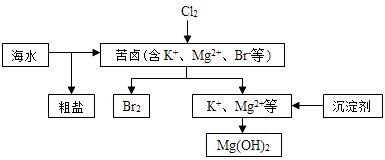
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com