
 某可逆反应X(g)+Y(g)?Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
某可逆反应X(g)+Y(g)?Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
| c(Z)?c2(W) |
| c(X)?c(Y) |
| c(Z)?c2(W) |
| c(X)?c(Y) |
| c(Z)?c2(W) |
| c(X)?c(Y) |



 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
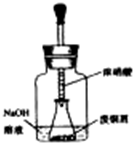 实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 抗酸药X 【药品名称】:X 规格:2g:0.5g,2g/袋×20袋/盒 【用法用量】:直接口服或温水冲服,1~2袋/次,3~4次/天.除非另有医嘱,一般成人在餐后1~2小时、睡前或胃不适时服用.病情严重者遵医嘱增加剂量.儿童遵医嘱服用.治疗胃和十二指肠溃疡时,在症状缓解后,至少维持4周. 【适应症】:1.急、慢性胃炎.2.胃、十二脂肠溃疡.3.反流性食管炎.4.与胃酸有关的胃部不适症状,如胃痛、胃灼烧、酸性暖气、饱胀等.5.预防非甾体类药物引起的胃粘膜损伤. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“玉兔号”的太阳能电池板主要由二氧化硅制成 |
| B、3He与3H互为同位素 |
| C、锂在空气中燃烧的产物中含有共价键 |
| D、铝、钾同时加入水中,铝可能完全溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com