
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
| A、第①组溶液中c(Fe3+)=3.0mol/L |
| B、第②组剩余固体是铁和铜 |
| C、第④组反应后的滤液中c(Fe2+)=6mol/L |
| D、原混合粉末中n(Fe):n(Cu)=3:2 |
| 1.28 |
| 64 |
| 11.2 |
| 56 |
| 1.28 |
| 64 |
| 0.4mol-0.2mol |
| 0.1L |
| 36g |
| (56+64)g/mol |
| 11.2g |
| 56g/mol |
| 0.2mol+0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、向某无色溶液中仅加入AgNO3溶液,以检验未知溶液中的Cl- | ||
| B、用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | ||
C、向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO
| ||
| D、用加入适量铜粉的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 所选的鉴别试剂 | 被鉴别的一组物质 |
| A | 硫酸 | 碳酸钠溶液、硫化钠溶液、氯化钡溶液、食盐水 |
| B | 烧碱溶液 | 硫酸铵溶液、硫酸铜溶液、氯化镁溶液、明矾溶液 |
| C | FeCl3溶液 | 硝基苯、苯酚溶液、溴苯、石灰水、碳酸钠溶液 |
| D | 水 | 电石、大理石、硫酸铜、硫酸镁 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:1 |
| C、9:2 | D、8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钾 | B、氯化汞 |
| C、氯化镁 | D、氯化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时在阳极得到氯气,在阴极得到金属钠 |
| B、在阳极附近有黄绿色的气体产生 |
| C、在阴极附近的溶液中滴入酚酞溶液,溶液呈无色 |
| D、电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C3H4,体积比为1:1 |
| B、C2H2和C2H6,体积比为3:1 |
| C、C2H4和C2H6,体积比为2:1 |
| D、C2H2 和C2H4,体积比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 装置 | 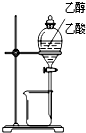 | 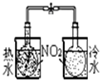 | 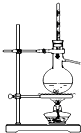 |  |
| 实验 | 分离乙醇和乙酸 | 证明温度对化学平衡的影响 | 分离沸点相差较大的互溶液体混合物 | 制取并收集氨气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com