
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构。
②Z元素原子核内质子数比Y元素原子核内质子数少9个。
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的名称:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式为_______________________________________。
(3)用电子式表示X、Z形成化合物的过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
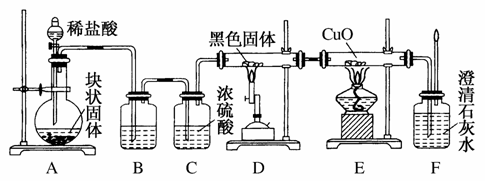
(1)写出装置A中所发生反应的离子方程式________________。
(2)装置B中最适宜的试剂是________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________________________________。
(4)装置D中黑色固体为________(填名称),反应的化学方程式为______________________________。
(5)按照如图装置进行实验时,首先进行的操作是____________________________________。
(6)根据实验中的________________现象,可证明CO具有还原性,有关反应的化学方程式是______________________________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号)。
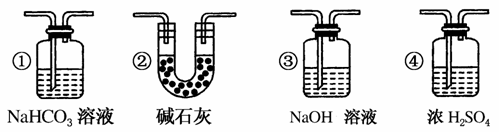
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物12 g完全燃烧,生成7.2 g H2O和8.96 L CO2(标准状况下),0.5 mol此有机物的质量为30 g。
(1)求分子式。
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种有机物的结构简式为:
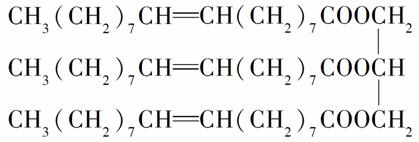
试回答下列问题:
(1)该化合物是________(填选项字母,下同)。
A.烯烃 B.油脂
C.蛋白质 D.糖类
(2)该化合物的密度________。
A.比水大 B.比水小
C.与水相同
(3)常温下该化合物呈________。
A.液态 B.固态
C.气态
(4)下列物质中,能与该物质反应的有________。
A.NaOH(aq) B.溴水
C.乙醇 D.乙酸
E.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表短周期元素中,A元素原子的最外层电子数是其电子层数的3倍;B元素的单质与A元素的单质化合生成化合物B2A2淡黄色固体;C元素的阳离子与A元素的阴离子电子层结构相同,0.1 mol C单质与足量盐酸反应,生成的H2在标况下体积为3.36 L;D元素与C元素同周期,D是该周期中非金属性最弱的非金属元素。
(1)各元素的符号是A________、B________、C________、D________。
(2)B元素的单质与A元素的单质化合生成化合物B2A2的化学方程式为____________________________________________。
(3)C的最高价氧化物对应水化物与NaOH溶液反应的化学方程式为________________________。
(4)D的原子结构示意图为________;气态氢化物分子式为________。
(5)物质的量相同的C和D分别与足量的强碱溶液反应生成气体的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):________,理由是______________________________。
(2)Y是________,Z是________,W是________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1。写出该化合物的名称及化学式______________,____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:
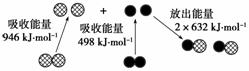
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N键的键能为____________kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:
________________________________________________________________________。
(2)NO(g)分解生成N2(g)和O2(g)的热化学方程式为________________;当有16 g O2(g)生成时,该反应中放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ·mol-1
③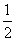 H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)===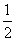 Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ·mol-1
④C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
⑤CO(g)+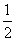 O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)===2H2O(l)
ΔH=-517.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有_________________________________________,
不正确的理由分别是____________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:
________________________________________________________________________。
(3)上述反应中,表示标准燃烧热的热化学方程式有________________________________;
表示中和热的热化学方程式有______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com