
| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;偏铝酸根离子与铵根离子发生双水解反应;
B.在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中存在大量氢离子或氢氧根离子,铜离子与次氯酸根离子发生双水解反应,铜离子与氢氧根离子反应,次氯酸根离子与氢离子反应;
C.加入铝粉产生 H2 的溶液中存在大量氢离子或企业广告离子,铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气;
D.使红色石蕊试纸变蓝的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.NH4+、AlO2-之间发生双水解反应,HCO3-、AlO2-之间反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故A错误;
B.在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Cu2+、ClO-之间发生双水解反应,Cu2+与氢氧根离子反应,ClO-与氢离子反应,在溶液中一定不能大量共存,故B错误;
C.加入铝粉产生 H2 的溶液为酸性或强碱性溶液,NH4+与强碱性溶液中的氢氧根离子反应,在酸性条件下NO3-具有强氧化性,与Al反应不会生成氢气,故C错误;
D.使红色石蕊试纸变蓝的溶液为碱性溶液,溶液中存在大量氢氧根离子,SiO32-、CO32-、Na+、F-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
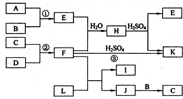 图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.
图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
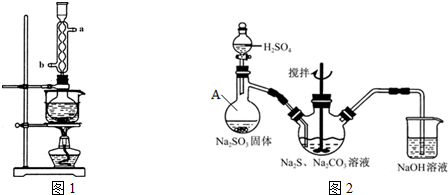
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| X | 单质为双原子分子,在空气中所占体积约为78% |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
 ;
; ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
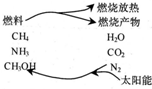
| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
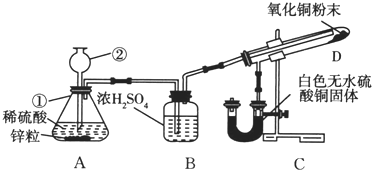 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com