
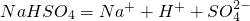
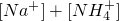 ______
______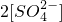 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中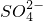 完全沉淀,则反应后溶液的PH=______7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH=______7(填“>”、”=”或“<”)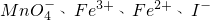 的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:
的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HClO | Ka=3×10-8 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)运用相关原理,回答下列各小题:
已知:![]() 在水中的电离方程式为
在水中的电离方程式为![]()
(1)常温下,PH=5的![]() 溶液中水的电离程度 PH=9的
溶液中水的电离程度 PH=9的![]() 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的![]() 与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则
![]()
![]() (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中![]() 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
(3)将分别含有![]() 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
①若![]() 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
查看答案和解析>>
科目:高中化学 来源:2013届山东省莱芜市第一中学高三12月阶段性测试化学试卷 题型:填空题
运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为 NaHSO4=Na+ + H+ + SO42-
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 pH=9的NH3·H2O中水的电离程度。(填 “>”、“=”或“<”)
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则[Na+]+[NH4+] 2[SO42-](填 “>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。(填“>”、“=”或“<” )
(3)将分别含有MnO4-、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH值,使pH=1,
充分反应后:
①若I-离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省莱芜市高三上学期期末检测化学试卷 题型:填空题
(14分)运用相关原理,回答下列各小题:
已知: 在水中的电离方程式为
在水中的电离方程式为
(1)常温下,PH=5的 溶液中水的电离程度 PH=9的
溶液中水的电离程度 PH=9的 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的 与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则

 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
(3)将分别含有 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
①若 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com