
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
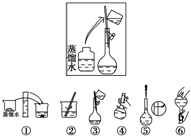 某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )
某同学帮助水质检测站配制500mL 0.5mol•L-1NaOH溶液以备使用.其操作步骤如图所示,则方框中操作的位置为( )| A. | ①与②之间 | B. | ②与③之间 | C. | ④与⑤之间 | D. | ⑤与⑥之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 在标准状况下,2.24 L四氯甲烷中所含分子数为0.1NA | |
| D. | 1 mol苯分子中含有碳碳双键数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84消毒液含有次氯酸钠,洁厕灵中含有盐酸,二者混合使用会产生氯气使人中毒 | |
| B. | 输送氯气的管道漏气,可以用浓氨水检验,是因为氯气和氨气发生化合反应生成氯化铵. | |
| C. | 因氯气消毒过的自来水不宜直接用来养金鱼,最好在阳光下晒一段时间 | |
| D. | 氯气和二氧化硫均有漂白性,二者按体积比1:1混合后不能是有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
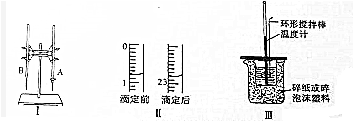
| 编号 | 待测盐酸的体积(ml) | 滴定前KOH溶液的体积(ml) | 滴定后KOH溶液的体积(ml) |
| 1 | 20.0 | 1.20 | 23.22 |
| 2 | 20.0 | 0.25 | 24.25 |
| 3 | 20.0 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中反应 | ||
| C. | 二氧化硫通入石灰水 | D. | 硫在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
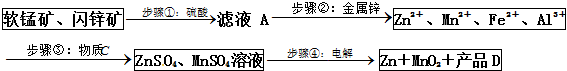
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com