
分析 (1)反应焓变△H<0说明反应为放热反应,△H>0说明反应为吸热反应;
(2)依据热化学方程式计算,2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol;
(3)结合①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-126.4kJ/mol,②2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol,反应的定量关系计算判断.
解答 解:(1)①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-126.4kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol
③2H2(g)+SO2(g) S(g)+2H2O(g)△H=+90.4kJ/mol,反应焓变大于0为吸热反应,焓变小于0为放热反应,则①②为放热反应,
故答案为:①②;
(2)2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol,反应中4g氢气完全反应放热659.6kJ,2g H2(g)完全反应时放热=$\frac{659.6KJ}{2}$=329.8KJ,反应焓变△H=-329.8KJ/mol,
故答案为:-329.8;
(3)等质量的C、H2分别发生反应①、②,依据热化学方程式计算比较,设碳和氢气质量为1g,
①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-126.4kJ/mol,
1mol 126.4KJ
$\frac{1}{12}$mol 放热=10.53KJ
②2H2(g)+O2(g)═2H2O(g)△H=-659.6kJ/mol,
2 659.6KJ
$\frac{1}{2}$mol 放热=164.9KJ
等质量的C、H2分别发生反应①、②,热量变化多的是H2,
故答案为:H2.
点评 本题考查了热化学方程式的计算应用,主要是反应焓变的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
 葡萄可用于酿酒.
葡萄可用于酿酒.| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为:90 |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有丰富的碘元素,因此碘被称为“海洋元素” | |
| B. | 地沟油经过加工处理后可用来制生物柴油和肥皂 | |
| C. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 | |
| D. | 大量使用薪柴为燃料,践行低碳生活 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | 2H2O+2F2=4HF+O2 | ||
| C. | ICl+H2O=HCl+HIO | D. | 2Na+2H2O=2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙电极附近溶液的pH减小 | |
| B. | 电极丁的反应式为:MnO42--e-═MnO4- | |
| C. | KOH溶液的质量分数:c%>a%>b% | |
| D. | 导线中有2 mol电子通过时,理论上有2 mol K+移入阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
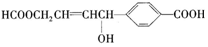 性质叙述正确的是( )
性质叙述正确的是( )| A. | 1 mol该有机物可以与3 mol Na发生反应 | |
| B. | 1 mol该有机物可以与3 mol NaOH发生反应 | |
| C. | 1 mol该有机物可以与6 mol H2发生加成反应 | |
| D. | 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: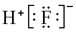 | B. | 白磷分子的球棍模型: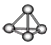 | ||
| C. | CO2分子的球棍模型: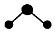 | D. | K+离子的结构示意图: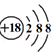 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 放电时Ni2O3在正极被氧化 | |
| D. | 电池放电时,OH-往负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com