
(14分)
I.甲、乙、丙、丁四种物质存在转化关系:
(1)若甲、乙均为空气主要成分,甲所含元素的简单阴离子的结构示意图为 。
(2)若乙是生活常见金属单质,丙→丁的离子方程式为 。
(3)若丙既能与强酸又能与强碱反应,则丙的化学式为 (任写1种)。
II.一定温度下,容积为1 L的密闭容器中投入0.5 mol PCl5(g),存在平衡:PCl5(g) PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
时间 | n(PCl5)/mol | n(PCl3)/mol | n(Cl2)/mol |
0 | 0.5 | 0 | 0 |
t1 | 0.45 | ||
t2 | 0.1 | ||
t3 | 0.4 |
(4)t1时刻,测得反应吸收的热量为a kJ。PCl3(g)与Cl2(g)反应的热化学反应方程式为 。
(5)t2时:v正 v逆(填“>”、“<”或“=”)。
(6)相同温度下,改为往容器中投入0.2 mol PCl5(g)、0.2 mol PCl3(g)、0.1 mol Cl2(g),到达平
衡前,PCl5的物质的量将 (填“增大”、“减小”、“不变”)。
(15分)
(1) (2)2Fe3++ Fe = 3Fe3+ (3)Al(OH)3、NaHCO3
(2)2Fe3++ Fe = 3Fe3+ (3)Al(OH)3、NaHCO3
(4)PCl3(g)+ Cl2(g) 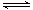 PCl5(g) △H = -20akJ/mol
PCl5(g) △H = -20akJ/mol
(5)= (6)增大
【解析】
试题分析:(1)若甲、乙均为空气主要成分,则甲为N2,乙为O2,丙为NO,丁为NO2 ,则N3-的结构示意图为 。
。
(2)若乙是生活常见金属单质,则乙是铁,甲为Cl2 ,丙为FeCl3 ,丁为FeCl2 ,丙→丁的离子方程式为2Fe3++ Fe = 3Fe3+。
(3)若丙既能与强酸又能与强碱反应,则丙为Al(OH)3 ,则转化流程为AlCl3 –Al(OH)3 –[Al(OH)3]-或NaHCO3 ,转化流程为CO2 –NaHCO3 –Na2CO3 。
(4) PCl5(g) PCl3(g)+ Cl2(g)
PCl3(g)+ Cl2(g)
起始 0.5 0 0
变化 0.05 0.05 0.05
t1时刻0.45 0.05 0.05
t1时刻,反应掉0.05molPCl5 ,测得反应吸收的热量为a kJ,则PCl3(g)与Cl2(g)反应的热化学反应方程式为PCl3(g)+ Cl2(g) 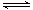 PCl5(g) △H = -20akJ/mol。
PCl5(g) △H = -20akJ/mol。
(5)PCl5(g) PCl3(g)+ Cl2(g)
PCl3(g)+ Cl2(g)
起始 0.5 0 0
t1时刻0.45 0.05 0.05
t2时刻0.4 0.1 0.1
t3时刻0.4 0.1 0.1 t2时刻、t3时刻PCl5 的浓度没变,说明平衡处于平衡状态,v正=v逆
(6)由(5)计算K=(0.1×0.1)÷0.4=0.025 ,根据数据可得Q=(0.1×0.2)÷0.2=0.1>K,平衡逆向移动,PCl5的物质的量将增大。
考点:考查物质转化的有关判断,热化学方程式的书写,平衡状态的判断等知识。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
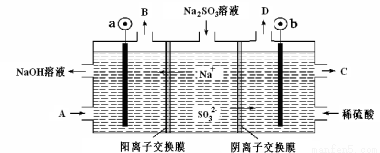
A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+
B.若D是混合气体,则可能含有SO2、O2等成分
C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:推断题
[化学―选修5:有机化学基础](15分)塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示:
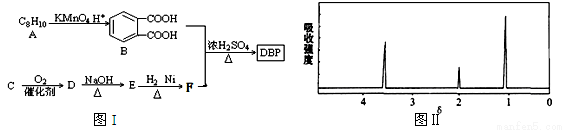
已知以下信息:
①
②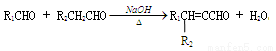 (—R1、R2表示氢原子或烃基)
(—R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图II所示
(1)C的结构简式为 ,E中所含官能团的名称是 。
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F: ;
②B和F以物质的量比1︰2合成DBP: ;反应类型为 。
(3)同时符合下列条件的B的同分异构体有 种,写出其中任意两种同分异构体的结构简式 。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeC13溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
(15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示
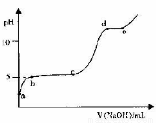
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
化学家及其突出贡献为: ①波义耳(化学元素概念);②道尔顿(原子学说);③门捷列夫(元素周期律);④玻尔(玻尔原子模型)。这些突出贡献提出的年代顺序是
A.①②③④ B.②④①③ C.③①④② D.③④①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月教学质量检查理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的位置如右图,其中X元素的原子最外层电子数等于其电子层数。
下列说法不正确的是
Z | W | ||
X | Y |
A.X位于元索周期表中第3 周期、ⅢA族
B.原子半径:X > Z > W
C.最简单气态氢化物的热稳定性:W > Y
D.Y的最高价氧化物可以和W的最简单氢化物反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:填空题
(14分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答问题:
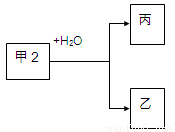
I、已知:甲是常见单质,丙为氢气。
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为 。
(2)若甲为碳,则产物乙、丙可合成甲醇。
①已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:__________________。
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表。则T1 ______ T2(填“>”、“<”、“=”)。
温度/℃ | T1 | T2 |
K | 2.041 | 0.012 |
③乙可做某碱性燃料电池的燃料,该电池的负极反应式为_________________。
II、已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(4)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省深圳市南山区上学期高一化学期末试卷(解析版) 题型:选择题
某溶液中加入金属铝有氢气放出,则在此溶液中可能大量共存的离子是
A.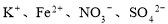 B.
B.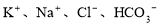
C.K+、Na+、AlO2-、SO42- D.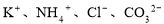
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com