
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
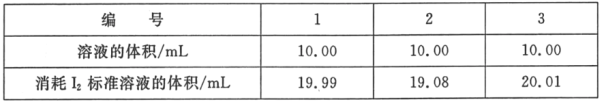
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
【答案】S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O 当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化 偏低 从表格中可以看出,第二次滴定误差较大,不应计算在平均值里面,消耗I2标准溶液的平均值为20.00mL。由2S2O32﹣+I2═S4O62﹣+2I﹣,可知5.5g样品中n(Na2S2O35H2O)=n(S2O32﹣)=2n(I2)=2×0.02L×0.05mol/L×![]() =0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为
=0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为![]() ×100%=90.18%,故答案为:90.18%。
×100%=90.18%,故答案为:90.18%。
【解析】
(1)碱性条件下二者发生氧化还原反应生成氯离子和硫酸根离子;(2)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为溶液变蓝色且半分钟内不褪色;依据反应的定量关系2S2O32﹣+I2=S4O62﹣+2I﹣计算碘单质消耗的硫代硫酸钠,计算得到样品中的质量分数。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,反应的离子方程式为S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O,故答案为:S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl+5H2O;
(2)①加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变,说明Na2S2O3反应完毕,滴定到达终点,故答案为:当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪去且半分钟内不再变化;
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则Na2S2O3反应不完全,导致测定结果偏低,故答案为:偏低;
③第2次实验消耗标准液的体积与其它2次相差比较大,应舍弃,1、3次实验的标准液平均值为消耗标准液体积,即消耗标准液体积为20mL,由2S2O32﹣+I2═S4O62﹣+2I﹣,可知5.5g样品中n(Na2S2O35H2O)=n(S2O32﹣)=2n(I2)=2×0.02L×0.05mol/L×![]() =0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为
=0.02mol,则m(Na2S2O35H2O)=0.02mol×248g/mol=4.96g,则Na2S2O35H2O在产品中的质量分数为![]() ×100%=90.18%,故答案为:90.18%。
×100%=90.18%,故答案为:90.18%。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子序数的说法正确的是
A. 原子序数是按照元素在周期表中的顺序给元素所编的号码
B. 元素的原子序数一定等于其原子相对质量
C. 元素的原子序数一定等于其最外层电子数
D. 元素的原子序数一定等于其核内中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是

A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.质子数相同而中子数不同的同一种元素的不同原子互为同素异形体
B.铁是人体必需微量元素中含量最多的一种
C.在水溶液中能导电的物质一般是电解质,如HCl、H2O 、NH3、CH3COOH、NaOH、AgCl都是电解质
D.元素周期表中每一个纵列为一个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一块未打磨过的铝片放入装有少量NaOH溶液的试管中,会发现开始没有气泡,一段时间后才产生气泡。请写出发生反应的离子方程式:___________,___________。
(2)将8gFe2O3投入到150mL某浓度的稀H2SO4中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe与Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为________。
(3)请写出制备漂白粉的离子方程式:____________。
(4)配平下列离子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
A. (NH3)= 0.002mol/(L·s)B. (O2)= 0.01mol/(L·s)
C. (NO)= 0.008mol/(L·s)D. (H2O)= 0.004mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
B.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.标准状况下,11.2L水中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com