
分析 (1)根据离子方程式遵循电荷守恒判断RO3n-离子所带电荷,判断化合价;根据生成R-离子可知R得1个电子后达到8电子稳定结构,最外层电子数等于族序数;
(2)由不同非金属元素形成的化学键为极性键;由同种非金属元素形成的化学键为非极性键;离子化合物中一定含有离子键、可能含有共价键,共价化合物中只含共价键;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子;
(4)酸性燃料电池中氧气在正极得电子生成水,根据正极和负极的电极反应式书写总反应.
解答 解:(1)根据离子方程式遵循电荷守恒可知:(-n)+(-6)+6=-1,可知n=1,根据RO3n-离子化合价代数和关系:(x-2×3)=-1(设R的化合价为x),可知x=+5,RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第ⅤⅡA族元素,最外层电子数为7,故答案为:+5;第ⅤⅡA;
(2)①K2O中含有离子键,是离子化合物;
②CO2 只含有极性共价键,是共价化合物;
③NH4Cl中含有离子键和极性共价键,是离子化合物;
④H2O2含有极性共价键和非极性共价键,是共价化合物;
⑤Na2O2含有离子键和非极性共价键,是离子化合物;
⑥NaOH含有离子键和极性共价键,是离子化合物;
故答案为:④;⑤;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子,则其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)酸性燃料电池中氧气在正极得电子生成水,其电极反应式为:O2+4H++4e-=2H2O,正极的电极反应式与和负极的电极反应式相加即是总反应,所以电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O,故答案为:CH3CH2OH+O2=CH3COOH+H2O.
点评 本题考查氧化还原反应、化学键、原电池的工作原理,题目难度中等,注意把握电极方程式的书写,特别是电解质溶液的酸碱性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
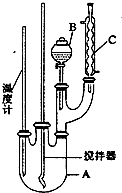 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: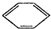 +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$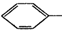 NO2+H2O△H<0
NO2+H2O△H<0| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属表面的氧化膜都很致密,能对金属起到保护作用 | |
| B. | 金属表面的氧化膜的形成都需要金属暴露在空气中很长时间才会形成 | |
| C. | 金属表面的氧化膜薄层的厚度会随着金属暴露在空气中的时间增长而加厚 | |
| D. | 某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
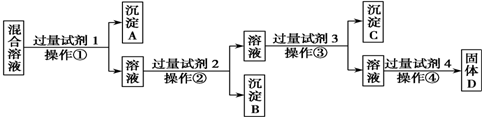
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com