
| A、Al(OH)3与氨水反应Al(OH)3+NH3?H2O═AlO2-+NH4++2H2O |
| B、铁跟三氯化铁溶液反应 Fe+2Fe3+═3Fe2+ |
| C、铝片浸入硝酸汞溶液 2Al+3Hg2+═2Al3++3Hg |
| D、明矾溶于水 Al3++3H2O═Al(OH)3+3H+ |


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、升高温度 |
| B、增大容器体积 |
| C、加入催化剂 |
| D、再加入一定量的TaS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物 |
| B、参加反应的n(Cu2S):n(HNO3)=1:7 |
| C、产物n[Cu(NO3)2]:n[CuSO4]=1:2 |
| D、1 molCu2S参加反应时有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用装置来做SO2的喷泉实验 |
B、 用装置来验证浓H2SO4与水混合的热量变化 |
C、 用装置来验证NH3易溶于水 |
D、 用装置来验证氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A、a、b、c代表的化学物质中均含化学键 |
| B、系列②物质均有氧化性;系列③物质对应水溶液均是强酸 |
| C、系列④中各化合物的稳定性顺序为H2O>H2S>H2Se>H2Te |
| D、上表内物质HF和H2O,由于氢键的影响,其分子特别稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
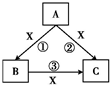 A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),回答下列问题:
A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
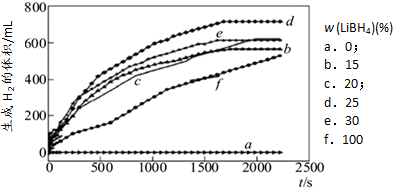
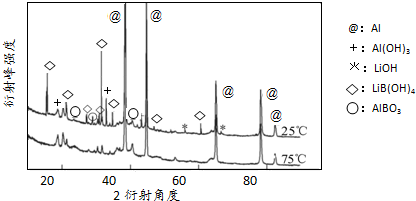
 (g)
(g)| FeSO4/Al2O3 |
| 高温 |
 (g)+)+3H2(g)
(g)+)+3H2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com