
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
分析 根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,非金属性最强的位于周期表右上角,但稀有气体除外,最不活泼的元素是稀有气体元素;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵或硫酸氢铵,写一个即可;
(3)同一周期,随着原子序数的递增,非金属性增强,氢化物还原性减弱,据此解答即可;
(4)核外电子排布相同的微粒,原子序数越小,半径越大,据此解答即可.
解答 解:根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,为K元素,名称为钾,非金属性最强的位于周期表右上角,为F元素,名称为氟,最不活泼的元素是稀有气体元素,为Ar元素,原子半径最小的元素是H,
故答案为:钾;氟;Ar;H;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵,反应方程式为:2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4;
(3)同周期自左而右非金属性增强,非金属性越强,氢化物还原性越弱,故氢化物还原性:HF<H2O<NH3,
故答案为:HF<H2O<NH3;
(4)S2-、Cl-、K+、Ca2+是核外电子排布相同的离子,原子序数越小,半径越大,故微粒中S2-的半径最大,Ca2+的半径最小,
故答案为:S2-.
点评 本题主要考查位置、结构与性质的关系,题目难度中等,明确元素非金属性、金属性强弱判断方法即可解答,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析、理解能力及灵活应用能力.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 | B. | 15 | C. | 25 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
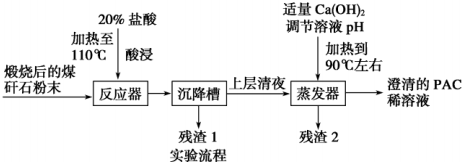
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
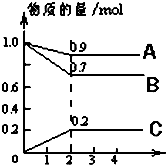 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | X、Y、Z离子半径依次增大 | |
| C. | Y和Z形成的简单离子都会破坏水的电离 | |
| D. | W、X、Z对应气态氢化物稳定性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com