
| A. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2将完全转化为NH3 | |
| D. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.达到化学平衡时,正反应和逆反应的速率相等但不为零,为动态平衡状态,故A错误;
B.达到化学平衡时,正逆反应速率相等,所以N2、H2和NH3的物质的量浓度不再变化,故B正确;
C.因为可逆反应存在平衡状态,反应物不能完全转化为生成物,所以其转化率小于100%,故C错误;
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不一定相等,与反应初始量及转化率有关,故D错误;
故选B.
点评 本题考查化学平衡状态的判断,明确化学平衡状态及可逆反应特点是解本题关键,易错选项是A,题目难度不大.


科目:高中化学 来源: 题型:解答题
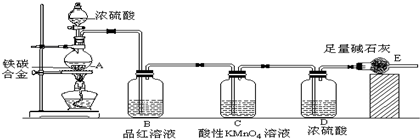
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
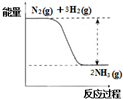 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
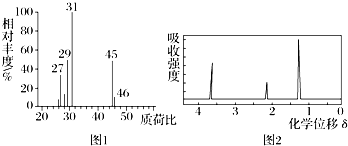
| A. | CH3CH2OH | B. | CH3CHO | C. | HCOOH | D. | CH3CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过加热分解HgO可制得单质Hg | |
| B. | 铝热法炼铁的还原剂是单质铝 | |
| C. | 高炉炼铁时,是还原剂CO将铁从铁矿石中还原出来 | |
| D. | 蔗糖、果糖和葡萄糖都可以发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯均为不饱和烃,都能发生加成反应 | |
| B. | 加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 | |
| C. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有一种元素的物质一定是纯净物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 石墨转变为金刚石为化学变化 | |
| D. | 水很稳定是因为水分子间存在较强的分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
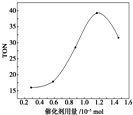 在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )
在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:CO2+2CH3OH-→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5 mol时,该反应的TON达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com