
| ||
科目:高中化学 来源: 题型:
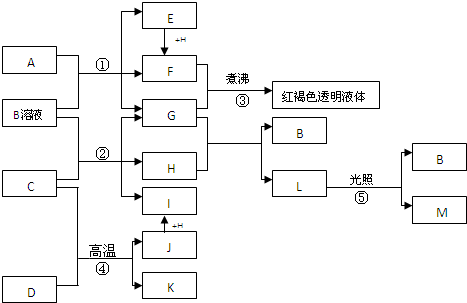
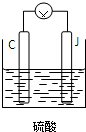
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
| F | 2- 6 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2+![]() +4H+====Mn2++2CO2↑+2H2O
+4H+====Mn2++2CO2↑+2H2O
2![]() +5
+5![]() +16H+====2Mn2++10CO2↑+8H2O
+16H+====2Mn2++10CO2↑+8H2O
通过如下实验测定软锰矿中MnO2的质量分数。
①准确称取软锰矿样品m g于烧杯中,加入过量草酸钠(Na2C2O4)和足量的稀硫酸,加热至反应完全(杂质不参加反应);
②冷却、过滤、洗涤,洗涤液及滤液全部转移至500 mL容量瓶并定容;
③从容量瓶中取出25.00 mL溶液于锥形瓶中,以0.0200 mol·L-1的KMnO4标准溶液滴定,当滴入20.00 mL KMnO4溶液时达滴定终点。
请回答下列问题:
(1)实验步骤①中草酸钠必须加入过量的目的是__________________________________。
(2)实验步骤②中若未将洗涤液(含洗涤滤出物、盛滤液的烧杯及玻棒)全部转移入容量瓶,将导致测量结果____________。(填“偏高”“偏低”或“无影响”)
(3)实验步骤③中KMnO4标准溶液应置于____________(填“酸式”或“碱式”)滴定管中。判断达到滴定终点的现象是__________________________________________。
(4)欲实现本实验的目的,实验中还应准确获得的数据是____________。请用设定的物理量结合测定的数据表示出该软锰矿中MnO2的质量分数:____________。
(5)完成本实验的化学原理有多种。例如:
①4MnO2![]() 2Mn2O3+O2↑;
2Mn2O3+O2↑;
②3MnO2+4Al![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
③MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
试从化学实验方案设计的科学性、简约性等评估,上述原理中适宜的是__________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com