
【题目】有机物M和乙炔可合成![]() 羟基丁酸,
羟基丁酸,![]() 羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。
羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C。

已知:(1).
(2)![]()
(3)
(4)C的结构中不含有甲基
![]() A的结构简式为______,B的分子式______。
A的结构简式为______,B的分子式______。
![]() 反应
反应![]() 的反应类型______。
的反应类型______。
![]() 写出反应
写出反应![]() 化学方程式______。
化学方程式______。
![]() 某烃S是
某烃S是 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,写出烃S可能的结构简式中的其中两种______。
![]() 理论上A也可以由1,
理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为______。
丁二烯与烃F来合成,则F的结构简式为______。
【答案】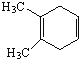
![]() 加成反应或还原反应
加成反应或还原反应 ![]()
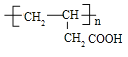
![]() 、
、![]() 、
、![]() 任意2种
任意2种![]()
![]()
【解析】
M与乙炔发生信息i中加成反应生成A为 ,A发生信息ii中氧化反应生成B,B与氢气发生反应生成
,A发生信息ii中氧化反应生成B,B与氢气发生反应生成![]() 羟基丁酸,故B为
羟基丁酸,故B为![]()
![]() 羟基丁酸也可以通过两步反应形成另一种高聚物C,C的结构中不含有甲基,则应先发生消去反应生成
羟基丁酸也可以通过两步反应形成另一种高聚物C,C的结构中不含有甲基,则应先发生消去反应生成![]() ,
,![]() 发生加聚反应得到C,故C为
发生加聚反应得到C,故C为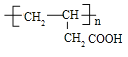
![]() 故
故![]() 羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为
羟基丁酸通过酯化反应进行的缩聚反应反应生成PHB,则PHB为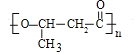 。
。
解:⑴由分析可知,A的结构简式为 ,B的结构简式为
,B的结构简式为![]() ,B的分子式为:
,B的分子式为:![]() ,
,
故答案为: ;
;![]() ;
;
⑵反应![]() 是
是![]() 发生加成反应生成
发生加成反应生成![]() 羟基丁酸,也属于还原反应,
羟基丁酸,也属于还原反应,
故答案为:加成反应或还原反应;
⑶反应![]() 是
是![]() 发生加聚反应生成
发生加聚反应生成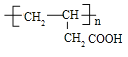 ,反应方程式:
,反应方程式:![]()
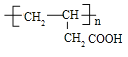 ,
,
故答案为:![]()
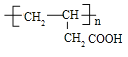 ;
;
⑷某烃S是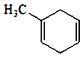 的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,烃S可能的结构简式有:
的同分异构体,分子中没有环状结构,核磁共振氢谱有三个峰,峰面积之比为6:3:1,烃S可能的结构简式有:![]() 、
、![]() 、
、![]() ,
,
故答案为:![]() 、
、![]() 、
、![]() 任意2种
任意2种![]() ;
;
⑸A为 ,理论上A也可以由1,
,理论上A也可以由1,![]() 丁二烯与烃F来合成,则F的结构简式为:
丁二烯与烃F来合成,则F的结构简式为:![]() ,
,
故答案为:![]() 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
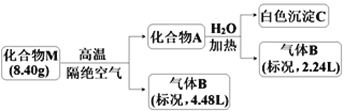
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是![]()
![]()
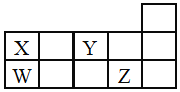
A.四种元素中原子半径最大为W,Y元素通常没有最高正价
B.酸性:![]()
C.![]() 、
、![]() 中所含化学键类型相同,熔点都很高
中所含化学键类型相同,熔点都很高
D.W、X形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值。下列叙述正确的是
表示阿伏加德罗常数的值。下列叙述正确的是![]()
![]()
A.1mol的碳烯![]() :
:![]() 含电子数为6
含电子数为6![]()
B.一定温度下,15g甲醛和乙酸的混合物含O原子数为![]()
![]()
C.常温常压下,![]() g乙醇中含有
g乙醇中含有![]() 键的个数为
键的个数为![]()
![]()
D.标准状况下,![]() L庚烷完全燃烧后生成的
L庚烷完全燃烧后生成的![]() 分子数为
分子数为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(1)该反应的还原剂是________,还原产物是________。
(2)该反应中氧化剂与氧化产物的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是( )
A.标准状况下,22.4LCl2中所含的原子数为2NA
B.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数目为0.5NA
C.0.5mol·L-1NaCl溶液中所含的氯离子数目为0.5NA
D.常温下,28g氮气中所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种应用广泛的金属,钠及其化合物在生产生活中应用广泛。某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
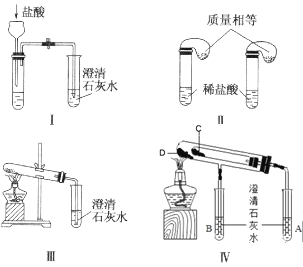
(1)只根据图中装置Ⅰ、Ⅱ所示实验,能够达到实验目的的是__(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式__、__;Ⅳ中现象为___;与实验Ⅲ相比,实验Ⅳ的优点___。
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管C中装入的固体是__(填化学式)。
(4)将适量钠投入下列溶液中,既能产生大量气体又能生成沉淀的是__(填写字母)
A.稀硫酸 B.氯化钠溶液 C.氯化镁溶液 D.硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和铁都是生活中常用的金属。
(1)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
①写出该反应的离子方程式__________________;
②用双线桥标出该反应电子转移的方向和数目___________________;
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
③若19.2g铜与足量硝酸完全反应,被还原的硝酸为______mol,氧化剂与还原剂物质的量之比为______。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出该反应的化学方程式___________________。
②检验溶液少量Fe3+存在的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:

请回答:
(1)X 的化学式是__________。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。
(3)白色沉淀用途广泛,请列举一例:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com