
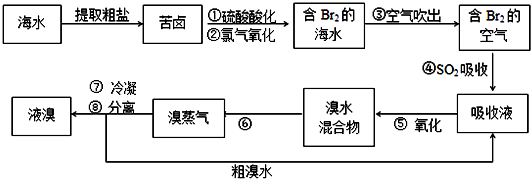
| 1 |
| 1+5 |
| 5 |
| 3 |
| 5 |
| 3 |


科目:高中化学 来源: 题型:
| A、生成是水分子中含有18O |
| B、生成的乙酸乙酯相对分子质量为88 |
| C、生成的乙酸乙酯的相对分子质量为90 |
| D、此反应是有限度的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
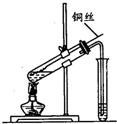 如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )
如图是实验室研究浓硫酸性质的实验,下列分析错误的是( )| A、该实验说明浓硫酸具有强氧化性 |
| B、反应后试管中观察到的白色固体CuSO4 |
| C、该实验产生的气体不会造成环境污染,因此不需尾气处理 |
| D、实验结束,将铜丝拉离液面终止反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱 | ||
| B、HCl溶液的酸性比H2S溶液的酸性强,则Cl的非金属性比S强 | ||
C、2C+SiO2
| ||
| D、测定NaCl和NaF溶液的pH,可确定F、Cl两元素非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com