
取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL 1.00mol•L﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol•L﹣1 Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL,1.00mol•L﹣1盐酸恰好完全中和.
求:
(1)n(CO2)= mol;
(2)m(Na2SO4)= g;
(3)m(NaHCO3)= g.
考点:
化学方程式的有关计算.
专题:
计算题.
分析:
(1)根据标况下CO2的体积,计算CO2的物质的量;
(2)Na2CO3、NaHCO3和Na2SO4的混合物与过量盐酸反应后,加入Ba(OH)2溶液后,由于碱过量,则Na2SO4全部生成的沉淀为BaSO4,利用S原子守恒,计算Na2SO4的质量;
(3)利用C原子守恒,根据 CO2的物质的量,计算出Na2CO3和NaHCO3的总物质的量,再利用消耗盐酸的物质的量,分别计算出Na2CO3和NaHCO3的物质的量,得到答案.
解答:
解:(1)CO2的体积为2.016L,则其物质的量为:n= =
=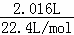 =0.09mol,故答案为:0.09;
=0.09mol,故答案为:0.09;
(2)混合物中Na2SO4的质量=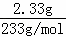 ×142g/mol=1.42g,故答案为:1.42;
×142g/mol=1.42g,故答案为:1.42;
(3)设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=0.09mol,与Na2CO3、NaHCO3反应的盐酸的物质的量为:0.250L×1.00mol/L﹣0.500L×0.100mol/L×2+0.0100L×1.00mol/L=0.160mol,则有:
x+y=0.09mol,根据化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,得出:2x+y=0.160mol,解得:x=0.07mol,y=0.02mol,NaHCO3质量=0.02mol×84g/mol=1.68g,故答案为:1.68.
点评:
本题考查了混合物的有关计算及化学方程式的计算,难度不大,应灵活运用原子守恒的观点.


科目:高中化学 来源: 题型:
关于0.1 mol·L-1Na2CO3溶液的叙述中错误的是 ( )
A.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol·L-1
B.1 L该溶液中含有Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为
0.01 mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是 (填序号),理由是 该反应既 .
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(l)+8H2O(l)△H>0
C.CaC2(s)+2H2O(l)═Ca(OH)2(s)+C2H2(g)△H<0
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0
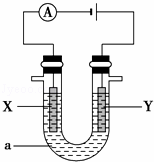
(2)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则电解时,检验Y电极反应产物的方法是 .
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验操作中,不慎将手指划破,这时可从急救箱中取FeCl3溶液止血,其原理是 .
(2)今有两瓶标签模糊不清,只知道分别盛有淀粉溶液和氯化钠溶液,试用2种方法对其鉴别.
① ;② .
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
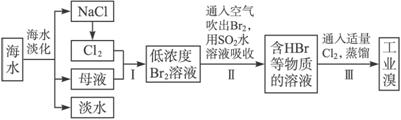
(1)请列举海水淡化的两种方法:__________________、__________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、_________、_________或H2、_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为__________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
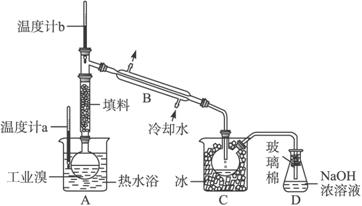
请你参与分析讨论:
①图中仪器B的名称:______________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_______________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_______________。
④C中液体产物颜色为_______________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com