
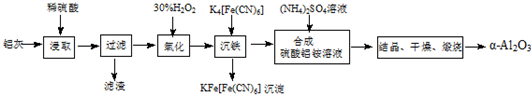
���� ���ҵ���Ҫ�ɷ�ΪAl2O3������������SiO2��FeO��Fe2O3����ϡ���ᣬAl2O3��FeO��Fe2O3ת��Ϊ���ӣ�SiO2���������ᣬ���ˣ���Һ�к���Al3+��Fe2+��Fe3+����˫��ˮ��Fe2+������ΪFe3+������K4[Fe��CN��6]Fe3+ת��Ϊ���������ˣ�����Һ�м�������泥�����NH4Al��SO4��2���ᾧ��������յõ���-Al2O3��
��1��Al2O3�����ᷴӦ������������ˮ��
��2��SiO2���������
��3����30%��H2O2��ҺFe2+������ΪFe3+���¶Ȳ��ܹ��߷�������������ȷֽ⣻
��4����NH4Al��SO4��2•12H2O�ֽ����ɵ�����NH3��SO3�������������գ�����������������գ�
��NH3��SO3�ܱ�����������Һ���գ�
��KMnO4���������Ӧ������������Ӻ������ӣ�
��� �⣺���ҵ���Ҫ�ɷ�ΪAl2O3������������SiO2��FeO��Fe2O3����ϡ���ᣬAl2O3��FeO��Fe2O3ת��Ϊ���ӣ�SiO2���������ᣬ���ˣ���Һ�к���Al3+��Fe2+��Fe3+����˫��ˮ��Fe2+������ΪFe3+������K4[Fe��CN��6]Fe3+ת��Ϊ���������ˣ�����Һ�м�������泥�����NH4Al��SO4��2���ᾧ��������յõ���-Al2O3��
��1��Al2O3�����ᷴӦ������������ˮ���䷴Ӧ�ķ���ʽΪ��Al2O3+3H2SO4=Al2��SO4��3+3H2O��
�ʴ�Ϊ��Al2O3+3H2SO4=Al2��SO4��3+3H2O��
��2�����ҵ���Ҫ�ɷ�ΪAl2O3������������SiO2��FeO��Fe2O3����ϡ���ᣬAl2O3��FeO��Fe2O3ת��Ϊ���ӣ�SiO2���������ᣬ���ˣ�����ΪSiO2��
�ʴ�Ϊ��SiO2��
��3����Һ�к���Al3+��Fe2+��Fe3+����30%��H2O2��ҺFe2+������ΪFe3+���䷴Ӧ�����ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O���÷�Ӧ������¶ȵ���40�棬��Ŀ���Ƿ�ֹH2O2�ֽ⣬
�ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O����ֹH2O2�ֽ⣻
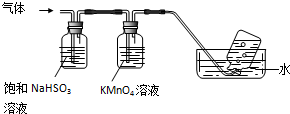
��4����NH4Al��SO4��2•12H2O�ֽ����ɵ�����NH3��SO3�������������գ�����������������գ����������ƿ���ռ�����������N2��
�ʴ�Ϊ��N2��
��NH3��������ˮ��NH3�����ܱ�����������Һ���գ�SO3��ˮ��Ӧ�����ᣬ��SO3Ҳ������������Һ���գ�������������NaHSO3��Һ���յ����ʳ���H2O��g�����SO3��NH3��
�ʴ�Ϊ��SO3��NH3��
�����������£�KMnO4���������Ӧ������������Ӻ������ӣ��䷴Ӧ�����ӷ���ʽΪ��2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��
�ʴ�Ϊ��2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+��
���� ��������������ȡ��������Ϊ���壬����Ԫ�ػ��������ʼ��ת����������ԭ�����ӷ���ʽ��ʵ�����������֪ʶ�㣬ע������Ʊ�ԭ�����������ʵ������Լ���ط�Ӧ����ʽ����д����Ŀ�Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �²���¶¶��˪��������֦����ױ | B�� | ���ϵ���˿����������ɻ���ʼ�� | ||
| C�� | �۹������벻�£�Ҫ��������˼� | D�� | Ī��ѩ�ڱ�����ѩ�ڳ�ˮˮ�ɱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
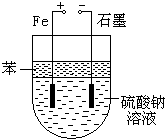 ʵ������NaOH��FeSO4��ȡFe��OH��2ʱ��Fe��OH��2�����ױ���������������ͼ��ʾװ����ȡ�����Եõ��ϴ�����Fe��OH��2��
ʵ������NaOH��FeSO4��ȡFe��OH��2ʱ��Fe��OH��2�����ױ���������������ͼ��ʾװ����ȡ�����Եõ��ϴ�����Fe��OH��2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | N��O | Cl-Cl | Cl-N | N=O |
| ����/kJ��mol-1 | 630 | 243 | a | 607 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ������������������ֱ���ȫȼ�գ����߷ų��������� | |
| B�� | ��ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų����ȴ���57.3kJ | |
| C�� | ��C��s��ʯī��=C��s�����ʯ����H=+1.90kJ/mol��֪��ʯīû�н��ʯ�ȶ� | |
| D�� | ��101kPaʱ��2g��������ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g��=2H2O��l����H=-285.8kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢݢ� | B�� | �ڢܢݢ� | C�� | ֻ�Т� | D�� | ֻ�Тݢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com