
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下: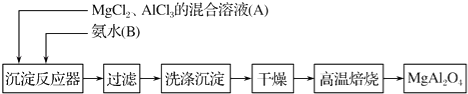
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式为 .
(2)判断流程中沉淀是否洗净所用的试剂是 .
(3)在25℃下,向浓度均为0.01mol/L的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式: .
【已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Al(OH)3]=3×10﹣34】
(4)将Mg、Al组成的9.9g混合物投入一定量稀硝酸中,恰好完全反应,共收集到还原产物NO气体6.72L(标准状况),向反应后的溶液中加入4mol/L的Na0H溶液300mL时,则形成沉淀的质量为g.
【答案】
(1)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O
(2)AgNO3溶液(或硝酸酸化的AgNO3溶液)
(3)Al(OH)3,Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(4)17.4
【解析】解:(1)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应生成MgAl2O4和H2O,反应的化学方程式为:2Al(OH)3+Mg(OH)2 ![]() MgAl2O4+4H2O;
MgAl2O4+4H2O;
(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净:可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净,若没有白色沉淀生成,则说明已经洗涤干净;
(3)向0.01molL﹣1的MgCl2中逐滴加入氨水,Ksp[Mg(OH)2]=c(Mg2+)[c(OH﹣)]2=0.01molL﹣1×[c(OH﹣)]2=1.8×10﹣11,c(OH﹣)= ![]() ×10﹣5,即当溶液中c(OH﹣)>
×10﹣5,即当溶液中c(OH﹣)> ![]() ×10﹣5时有Mg(OH)2沉淀生成;
×10﹣5时有Mg(OH)2沉淀生成;
向0.01molL﹣1AlCl3溶液中逐滴加入氨水,Ksp[Al(OH)3]=c(Al3+)[c(OH﹣)]3=0.01molL﹣1×[c(OH﹣)]3=3×10﹣34,c(OH﹣)= ![]() ×10﹣11,即当溶液中c(OH﹣)>
×10﹣11,即当溶液中c(OH﹣)> ![]() ×10﹣11时有Al(OH)3沉淀生成;向浓度均为0.01molL﹣1的MgCl2和AlCl3混合溶液中逐滴加入氨水,应先生成Al(OH)3沉淀,反应离子方程式应为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
×10﹣11时有Al(OH)3沉淀生成;向浓度均为0.01molL﹣1的MgCl2和AlCl3混合溶液中逐滴加入氨水,应先生成Al(OH)3沉淀,反应离子方程式应为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)硝酸被还原为NO气体且标准状况下体积为6.72L,物质的量为: ![]() =0.3mol,所以转移的电子的物质的量为:0.3mol×(5﹣2)=0.9mol,设金属Mg、Al组成的9.9g混合物中MgAl物质的量分别为:x、y,
=0.3mol,所以转移的电子的物质的量为:0.3mol×(5﹣2)=0.9mol,设金属Mg、Al组成的9.9g混合物中MgAl物质的量分别为:x、y,
2x+3y=0.9
24x+27y=9.9
x=0.3mol
y=0.1mol
向反应后的溶液中加入4mol/L的Na0H溶液300mL.n(OH﹣)=0.3L×4mol/L=1.2mol,
Mg2++ | 2OH﹣=Mg(OH)2↓ |
1 | 2 |
0.3mol | 0.6mol |
Al3++ | 3OH﹣= | Al(OH)3↓ |
1 | 3 | 1 |
0.1mol | 0.3mol | 0.1mol |
剩余氢氧化钠物质的量=1.2mol﹣0.9mol=0.3mol,
Al(OH)3+ | OH﹣=AlO2﹣+2H2O |
0.1mol | 0.1mol |
最后沉淀为Mg(OH)2,所以最后沉淀质量为:0.3mol×58g/mol=17.4g,
所以答案是:(1)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;(2)AgNO3溶液(或硝酸酸化的AgNO3溶液);(3)Al(OH)3;Al3++3NH3H2O=Al(OH)3↓+3NH4+;(4)17.4


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】(1)![]() 的放射性可用于考古断代,根据测定出土文物标本中
的放射性可用于考古断代,根据测定出土文物标本中![]() 的含量,就可以推算出文物的年代。
的含量,就可以推算出文物的年代。![]() 的中子数是______________。
的中子数是______________。
(2)碘元素的一种核素12553I可用于治疗肿瘤。该核素的质子数为__________,中子数为_____________,质量数为____________。
(3)写出铝原子的原子结构示意图___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.根据是否有丁达尔效应,将分散系分为溶液、胶体和浊液
B.SO2和SiO2都是酸性氧化物,都能与水反应生成酸
C.漂白粉、水玻璃、氨水均为混合物
D.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( ) ![]()
A.最高正化合价:X<Y<Z<W
B.原子半径:W<Z<Y
C.气态氢化物的热稳定性:Y<Z<W
D.最高价氧化物对应水化物的酸性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.SO2的摩尔质量是64g
B.18g H2O在标准状况下的体积是22.4L
C.在标准状况下,20mL NH3 与60mL O2所含的分子数比为1:3
D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知, ![]() ,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化. 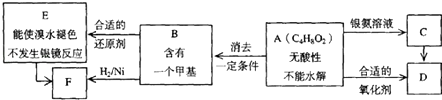
试回答:
(1)写出符合下述条件A的同分异构体结构简式(各任写一种): a.具有酸性b.能发生水解反应
(2)A分子中的官能团是 , D的结构简式是 .
(3)C→D的反应类型是 , E→F的反应类型是 a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B .
(5)写出E生成高聚物的化学方程式: .
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2 , 写出C2的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去).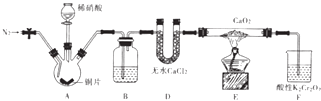
已知:2NO+CaO2═Ca(NO2)2;2NO2+CaO2═Ca(NO3)2
请回答下列问题:
(1)向三颈烧瓶中加入稀硝酸之前,应向装置中通入一段时间的N2 , 原因是 .
(2)仪器D的名称是;B中盛放的试剂是 .
(3)装置F中,酸性K2Cr2O7溶液可将剩余的NO氧化成NO3﹣ , 溶液由橙色变为绿色(Cr3+),发生反应的离子方程式是 .
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体.设计实验证明E中有亚硝酸钙生成 .
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2 , 反应原理为Ca(OH)2+NO+NO2=Ca(NO2)2+H2O.
①若n( NO):n(NO2)>1:1,则会导致:
②若n( NO):n( NO2)<1:1,则会导致 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯气的性质,某小组用如图所示的微型实验装置进行试验,a、b、c、d、e、是浸有相关溶液的滤纸.小组同学用KMnO4晶体与浓盐酸反应来制取少量的氯气,向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.其化学方程式为:KMnO4+HCl(浓)→KCl+Cl2↑+MnCl2+H2O (未配平),请回答下列问题: 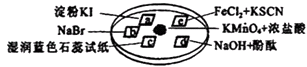
(1)上述反应中,元素的化合价升高;而元素被还原.
(2)配平上述反应: KMnO4+HCl(浓)═KCl+Cl2↑+MnCl2+H2O
(3)c处湿润蓝色石蕊试纸会先后 , 产生此现象的原因是: .
(4)e处滤纸的实验现象是: , 写出氯气与Fe2+反应的离子方程式是: .
(5)上述反应若在标准状况下产生56L的氯气,则转移电子为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com