
分析 (1)[Fe(CO)5]中铁原子与CO形成配位键;Fe的原子核外电子数为26,根据能量最低原理书写价电子排布式;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,等电子体的结构相似;
(3)碳原子采取sp3杂化,则分子中C原子杂化轨道数目为4,杂化轨道数目=σ键数+孤电子对数;CH3OH分子之间形成氢键,熔沸点高于甲烷的;
(4)CH3CHO分子中C原子均没有孤对电子,-CH3中的碳原子杂化轨道数目为4、-CHO中的碳原子杂化轨道数目为3.
解答 解:(1)[Fe(CO)5]中铁原子与CO形成配位键,Fe元素化合价为0价,Fe的原子核外电子数为26,基态电子排布式为[Ar]3d64s2,价电子排布式为:3d64s2,
故答案为:0;3d64s2;
(2)原子数目相等、价电子总数也相等的微粒互为等电子体,与CO互为等电子体的分子、离子分别为N2、CN-,
等电子体的结构相似,则CO与氮气分子结构相似,结构式为C≡O,该分子中含1个σ键、2个π键,.
故答案为:N2;CN-;C≡O;1;2;
(3)在CH4、CO、CH3OH三种物质中甲烷、甲醇中C原子杂化轨道数目为4,碳原子采取sp3杂化,CH3OH分子之间形成氢键,且为极性分子,则熔沸点高于甲烷的,
故答案为:CH4、CH3OH;CH3OH分子之间形成氢键,且为极性分子;
(4)CH3CHO分子中C原子均没有孤对电子,-CH3中的碳原子杂化轨道数目为4、-CHO中的碳原子杂化轨道数目为3,分别采取sp3杂化、sp2杂化,
故答案为:sp3;sp2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、化学键、分子结构与性质、杂化方式判断等,注意氢键对物质性质的影响.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
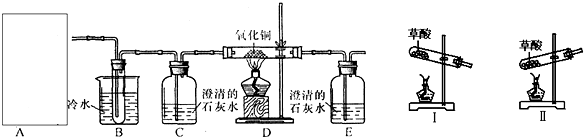
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | 氯化氢比溴化氢稳定,HClO4酸性强于HBrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
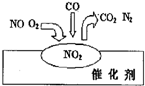
| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )
2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.从植物黄花蒿茎 叶中提取的,其结构简式如图,下列说法不正确的是( )| A. | 它的分子式为C15H2205 | |
| B. | 青蒿素易发生加成反应和氧化反应 | |
| C. | 青蒿素在碱性条件下易发生水解反应 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-═CO2↑+H2O | |
| B. | 铜和稀硝酸反应:Cu+2H+═H2↑+Cu2+ | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时MgxMo3S4只发生还原反应 | |
| B. | 放电时Mo3S4只发生氧化反应 | |
| C. | 充电时阳极反应式为 Mo3S42x--2xe-=Mo3S4 | |
| D. | 放电时负极反应式为xMg=xMg2+-2xe- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com