
| A、c(H+)>c(OH-) |
| B、c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(CH3COO-)+c(OH-)=0.1mol?L-1 |


科目:高中化学 来源: 题型:
| A、用银氨溶液鉴别HCOOCH3和CH3CHO |
| B、用溴水鉴别乙烯和乙炔 |
| C、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D、用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2NaCl(熔融)
| ||||
B、MgO+H2
| ||||
C、2Al2O3(熔融)
| ||||
D、Fe2O3+3CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
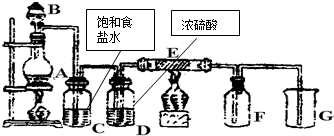 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常状况下,干燥的氯气能和Fe反应 |
| B、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加压强 |
| B、降低温度 |
| C、增大CO的浓度 |
| D、更换催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水形成的溶液能导电,故氯气是电解质 |
| B、没有氧元素参加的反应一定不是氧化还原反应 |
| C、在水中能电离出H+的化合物一定是酸 |
| D、有单质生成的分解反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com