
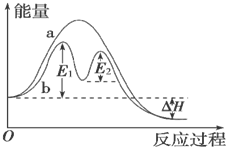
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
分析 A、催化剂能降低反应的活化能;
B、反应物能量高于生成物,据此判断反应的吸放热,根据热效应的判断来回答;
C、不同的催化剂对反应的催化效果不同;
D、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能.
解答 解:A、b中使用了催化剂,故A错误;
B、反应物能量高于生成物,反应为放热反应,△H=生成物能量-反应物能量,热效应等于△H,故B正确;
C、不同的催化剂,反应的活化能不同,改变催化剂,能改变该反应的活化能,故C错误;
D、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误.
故选B.
点评 本题通过图象考查了学生对反应的活化能的理解以及催化剂能够降低反应的活化能的相关知识,难度中等.


科目:高中化学 来源: 题型:解答题
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的特征是电子的转移 | |
| B. | 物质中某元素失去电子,则此物质是还原剂 | |
| C. | 有单质参与的反应一定是氧化还原反应 | |
| D. | 同种元素的价态越高,其氧化性一定越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO${\;}_{3}^{-}$═CO${\;}_{3}^{2-}$+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | H3PO4?3H++PO${\;}_{4}^{3-}$ | D. | NH3•H2O?NH${\;}_{4}^{+}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4 g | B. | 2.2 g | C. | 4.4 g | D. | 在2.2~4.4 g之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.002g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com