
| A. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| C. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
分析 A.向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后二者反应生成氯化钠、水和二氧化碳,根据物料守恒判断;
B.pH=3的醋酸浓度大于pH=11的NaOH溶液,二者等体积混合时,醋酸有剩余,溶液呈酸性,结合电荷守恒判断;
C.等浓度、等体积的醋酸和醋酸钠混合,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
D.混合溶液呈中性,则c(OH-)=c(H+),如果二者等体积混合,混合溶液中溶质为硫酸钠、硫酸铵,溶液呈酸性,要使混合溶液呈碱性,NaOH体积应该稍微过量.
解答 解:A.向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后二者反应生成氯化钠、水和二氧化碳,钠离子不反应,根据物料守恒得c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3),故A错误;
B.pH=3的醋酸浓度大于pH=11的NaOH溶液,二者等体积混合时,醋酸有剩余,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒判断c(CH3COO-)>c(Na+),所以c(CH3COO-)+c(H+)>c(Na+)+c(OH-),故B正确;
C.等浓度、等体积的醋酸和醋酸钠混合,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性,则c(H+)>c(OH-),钠离子不反应,所以离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故C错误;
D.混合溶液呈中性,则c(OH-)=c(H+),如果二者等体积混合,混合溶液中溶质为硫酸钠、硫酸铵,溶液呈酸性,要使混合溶液呈碱性,NaOH体积应该稍微过量,铵根离子水解,所以离子浓度大小顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选BD.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质、溶液酸碱性是解本题关键,注意电荷守恒和物料守恒的灵活运用,侧重考查学生分析判断能力,注意A中逸出部分二氧化碳,为易错点.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
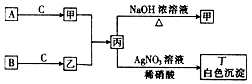 已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)
已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
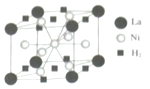 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: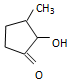 可形成配合物.
可形成配合物. 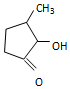 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置除去乙烯中少量SO2气体 | |
| B. |  用图装置量取20.00 mL 0.10 mol•L-1硫酸 | |
| C. |  用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 | |
| D. | 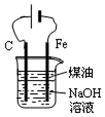 用图装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
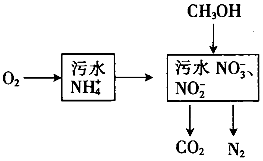 处理生活污水中的NH4+,过程如下:
处理生活污水中的NH4+,过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g丙烷含有共价键的数目为10NA | |
| B. | 1 L 1 mol•L-1的Na2CO3溶液中含有氧原子的数目为3NA | |
| C. | 常温常压下,11.2L由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
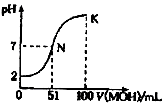 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | 滴入MOH溶液的体积为50ml时,(M+)>(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,则有c(MOH)+(M+)=0.02mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com