
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为__________。
(3)根据上述反应可推知__________(填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
 +
+
科目:高中化学 来源: 题型:
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):

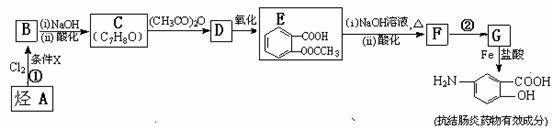
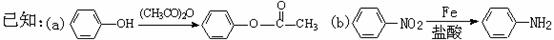
根据以上信息回答下列问题:
(1)烃A的结构简式是 。
(2)①的反应条件是 。 ②的反应类型是 。
(3)下列对抗结肠炎药物有效成分可能具有的性质推测正确的是: 。
A.水溶性比苯酚好,密度比苯酚的大 B.能发生消去反应
C.能发生聚合反应 D.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式是 。
(5)写出所有符合下列条件的E的同分异构体的结构简式: 。
a.与F具有相同的官能团 b.苯环上的一硝基取代产物有两种
(6)已知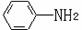 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料合成化合物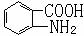 的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线 。(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、SCN-、SO42-
B.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3-
C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl-
D.水电离产生的c(H+) =10—12mol·L—1的溶液中:Na+、Fe2+、SO42—、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种
 脱硫技术的原理为FeS2 Fe2++SO42—
脱硫技术的原理为FeS2 Fe2++SO42—
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
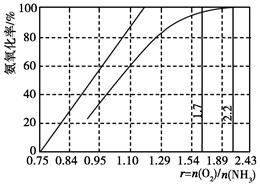
(4 )工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌的流程如下:
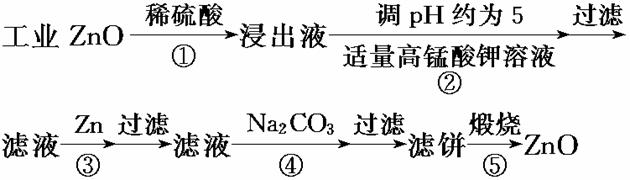
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________
_ ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
含金属元素的离子一定都是阳离子
在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从游离态变为化合态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是 ( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫红色 ②向FeCl2溶液中加入氯水,再加入KSCN溶液呈红色 ③向KMnO4溶液中加入浓盐酸后,振荡后紫色褪去
A.I2>Cl2>Fe3+>MnO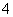 B.MnO
B.MnO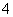 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
C.Cl2>I2>Fe3+>MnO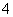 D.Fe3+>MnO
D.Fe3+>MnO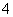 >Cl2>I2
>Cl2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
1)向NaHSO4溶 液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式
液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 :_________________________________________________
:_________________________________________________ ______。
______。
(2)向Ba(OH)2溶液中逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,请写出发生反应的离子方程式:____________________________________________。
(3)向Ba(OH)2溶液中逐 滴加入明矾[KAl(SO4)2·12H2O]至溶液中Ba2+恰好完全沉淀,反应的离子方程式是:_________________________________________。
滴加入明矾[KAl(SO4)2·12H2O]至溶液中Ba2+恰好完全沉淀,反应的离子方程式是:_________________________________________。
在以上溶液中 继续滴加明矾溶液,请写出此步反应的离子方程式:_________。
继续滴加明矾溶液,请写出此步反应的离子方程式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com