
【题目】某浓H2SO4 密度1.84 g/mL,物质的量浓度为18.4 mol/L,质量分数为98%,取10 mL浓H2SO4和a mL水混合得物质的量浓度为c mol/L,质量分数为b%。下列组合正确的是
(1)若c=9.2,则a>10 b>49
(2)若c=9.2,则a>10 b<49
(3)若b=49,则a=18.4 c<9.2
(4)若b=49,则a=18.4 c>9.2
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
【答案】A
【解析】若c=9.2,根据稀释定律计算稀释后溶液的体积,硫酸的浓度越大,密度越大,确定混合后溶液的质量与10 mL原浓硫酸质量关系,进而确定稀释后溶液质量分数;根据稀释过程中溶质硫酸的质量不变列方程计算a;若b=49,根据稀释过程中溶质硫酸的质量不变列方程计算a,结合c=![]() mol/L计算49%的硫酸的浓度,据此计算判断。若c=9.2,根据稀释定律,可知稀释后溶液的体积为10 mL×
mol/L计算49%的硫酸的浓度,据此计算判断。若c=9.2,根据稀释定律,可知稀释后溶液的体积为10 mL×![]() =20 mL,硫酸的浓度越大,密度越大,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,稀释过程中溶质硫酸的质量不变,则:10 mL×1.84 g/mL×98 %<(10 mL×1.84 g/mL+a mL×1 g/mL)×49%,解得a>18.4;若b=49,稀释过程中溶质硫酸的质量不变,则:10 mL×1.84 g/mL×98%=(10 mL×1.84 g/mL+a mL×1 g/mL)×49%,解得a=18.4,令稀释后的密度为d g/mL,则d<1.84,稀硫酸的物质的量浓度c=
=20 mL,硫酸的浓度越大,密度越大,故稀释后溶液的质量小于原浓硫酸质量的2倍,稀释过程硫酸的质量不变,故稀释后硫酸的质量分数大于49%,稀释过程中溶质硫酸的质量不变,则:10 mL×1.84 g/mL×98 %<(10 mL×1.84 g/mL+a mL×1 g/mL)×49%,解得a>18.4;若b=49,稀释过程中溶质硫酸的质量不变,则:10 mL×1.84 g/mL×98%=(10 mL×1.84 g/mL+a mL×1 g/mL)×49%,解得a=18.4,令稀释后的密度为d g/mL,则d<1.84,稀硫酸的物质的量浓度c=![]() mol/L<9.2 mol/L,故选A。
mol/L<9.2 mol/L,故选A。


科目:高中化学 来源: 题型:
【题目】将190 g MgCl2溶于水配制成1 L溶液。
(1)该溶液中MgCl2的物质的量浓度为________,溶液中Cl的物质的量浓度为________。
(2)配制1 mol/L的MgCl2溶液500 mL,需该溶液的体积为________。
(3)向(2)中500 mL溶液中再通入一定量的HCl气体后,溶液中Cl的浓度为3 mol·L1(假设溶液体积不变),则溶液中H+的物质的量浓度为_____, 通入HCl气体的体积(标况下)为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)![]() H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于Ss B.等于10 s C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国生态文明建设正在不断迈上新台阶,下列有利于保护生态环境的做法是( )
A. 大量使用一次性发泡塑料餐具
B. 提倡步行、骑自行车或乘公交出行
C. 超量开采地下水以补充城市用水
D. 无节制开发和使用石油、煤炭等化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl为1.8 mol,Na+为2 mol,Mg2+为0.5 mol,则![]() 的物质的量浓度为
的物质的量浓度为
A.0.6 mol /L B.0.7 mol /L C.1.2 mol /L D.1.0 mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
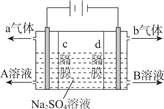
A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:

(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F. 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______________________________________________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极: __________________,总反应: ________________________________。
当电路中转移0.25 mol电子时,消耗负极材料的质量为________________ (Zn的相对原子质量65)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.06g某有机物A完全燃烧后,得到1.792 L CO2气体(标况)和0.9gH2O,该有机物对氢气相对密度是53。(第(1)1分(2)(3)各2分共5分)
(1)求该有机物的相对分子质量。
(2)求该有机物的分子式
(3)根据下述实验现象及结论是,确定该有机物的结构简式
①它不能与溴发生反应
②它能使KMnO4酸性溶液褪色
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com