
| A.c(Na+)=2c(CO32-) |
| B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) |
| C.c(CO32-)+c(HCO3-)=0.1 mol/L |
| D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
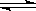 HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点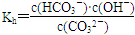
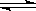 HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO3-+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点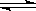 HCO3-+OH- 可得:
HCO3-+OH- 可得: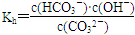


科目:高中化学 来源:不详 题型:单选题
 NH4++OH- ②HCO3- + H2O
NH4++OH- ②HCO3- + H2O H2CO3+OH-
H2CO3+OH- H3O++CO32- ④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
H3O++CO32- ④A13+ +3HCO3-=Al(OH)3↓+3CO2↑ NH3·H2O+H3O+
NH3·H2O+H3O+| A.①③⑤ | B.②③⑤ | C.①④⑤ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.0.01mol/L的H2CO3溶液 |
| B.0.01mol/L的NaHCO3溶液 |
| C.0.02mol/L的HCl与0.04mol/L的NaHCO3溶液等体积混合液 |
| D.0.02mol/L的NaOH与0.02 mol/L的NaHCO3溶液等体积混合液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液c(CH3COO-) > c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中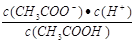 相等 相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCO3—+OH—平衡。下列说法不正确的是
HCO3—+OH—平衡。下列说法不正确的是A.稀释溶液, 增大 增大 | B.通入 ,溶液pH减小 ,溶液pH减小 |
| C.升高温度,此平衡常数增大 | D.加入NaOH固体, 减小 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,PH=7的CH3COONa和CH3COOH的混合溶液[c(Na+)=0.1mol/L]中各离子浓度关系:c(CH3COOH)>c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| B.0.1mol/LNa2CO3溶液中:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D.向0.2 mol/LNaHCO3溶液中加入等体积的0.1mol/LNaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③ | C.③④ | D.③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述溶液中,将①和②等体积混合,其溶液中粒子浓度关系为 2c(Na+)=3c(HCO-3)+3c(CO2-3)+3c(H2CO3) |
| B.上述四种溶液中,由水电离的c(OH-)的大小关系为:①>②>④>③ |
| C.上述四种溶液中,分别加水稀释,所得溶液中c(H+).c(OH-)的数值不变 |
| D.上述四种溶液中,分别加入少量的NaOH固体,此时溶液的pH均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com