
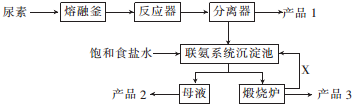
分析 尿素的熔点是132.7℃,常压下超过160℃即可分解,三聚氰胺的熔点是354℃,加热易升华,微溶于水,尿素在一定条件下分解生成三聚氰胺和氨气、二氧化碳,饱和食盐水加入联氨系统沉淀池,所以产品1为三聚氰胺;从联氨系统沉淀池中得到的母液中含有氯化铵,得到的沉淀是碳酸氢钠,煅烧碳酸氢钠得到二氧化碳,所以产品2是NH4Cl、产品3是Na2CO3、X是CO2,
(1)根据原子守恒配平方程式;在实验室使尿素熔化的容器的名称是坩埚;
(2)产品2是铵盐,X是二氧化碳;
(3)联氨系统沉淀池中发生反应生成氯化铵和碳酸氢钠;
(4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以增大反应物浓度.
解答 解:尿素的熔点是132.7℃,常压下超过160℃即可分解,三聚氰胺的熔点是354℃,加热易升华,微溶于水,尿素在一定条件下分解生成三聚氰胺和氨气、二氧化碳,饱和食盐水加入联氨系统沉淀池,所以产品1为三聚氰胺;从联氨系统沉淀池中得到的母液中含有氯化铵,得到的沉淀是碳酸氢钠,煅烧碳酸氢钠得到二氧化碳,所以产品2是NH4Cl、产品3是Na2CO3、X是CO2,
(1)根据原子守恒配平方程式为6CO(NH2)2$\stackrel{一定条件}{→}$ C3N6H6+6NH3↑+3CO2↑,在实验室使尿素熔化的容器的名称是坩埚,故答案为:6;1;6;3;坩埚;
(2)通过以上分析知,产品2是NH4Cl,X是CO2,故答案为:NH4Cl;CO2;
(3)联氨系统沉淀池中发生反应生成氯化铵和碳酸氢钠,反应方程式为CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3,故答案为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3;
(4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以增大反应物浓度,所以可以向溶液中加入氯化钠或者通入二氧化碳气体,
故选AC.
点评 本题考查物质制备,为高频考点,明确流程图中发生的反应及实验基本操作方法是解本题关键,熟悉氨碱法制备原理,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
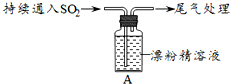 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
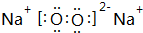 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝投入到氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
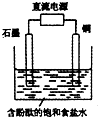
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质一定是共价化合物 | |
| B. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明NH3•H2O电离处于平衡状态 | |
| C. | 强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 | |
| D. | 由0.1 mol•L-1一元碱BOH的pH=10,可知溶液中存在BOH═B++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com