
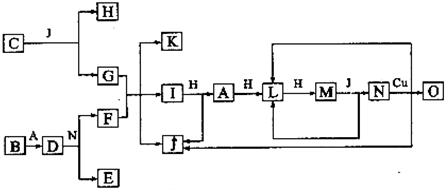
 .
.分析 B是由短周期元素组成的单质,B与冷水缓慢反应,与沸水迅速反应,放出氢气,可判断B为金属镁.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱,可以判断D为氮化镁,所以A为氮气. C为淡黄色固体化合物,可确定C为Na2O2.C与J反应得到G与H,O能与G的水溶液反应生成蓝色沉淀,说明有氢氧化铜生成,则G为NaOH,故J为H2O,H为O2,G与F反应得到K、I与水,且I连续与氧气反应生成M,M与水反应生成L与N,N能与Cu反应生成铜盐,故N为HNO3,则E为Mg(NO3)2,F为NH4NO3,K为NaNO3,I为NH3,故L为NO,M为NO2,O为Cu(NO3)2,据此解答.
解答 解:B是由短周期元素组成的单质,B与冷水缓慢反应,与沸水迅速反应,放出氢气,可判断B为金属镁.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反应得到两种碱,可以判断D为氮化镁,所以A为氮气. C为淡黄色固体化合物,可确定C为Na2O2.C与J反应得到G与H,O能与G的水溶液反应生成蓝色沉淀,说明有氢氧化铜生成,则G为NaOH,故J为H2O,H为O2,G与F反应得到K、I与水,且I连续与氧气反应生成M,M与水反应生成L与N,N能与Cu反应生成铜盐,故N为HNO3,则E为Mg(NO3)2,F为NH4NO3,K为NaNO3,I为NH3,故L为NO,M为NO2,O为Cu(NO3)2.
(1)组成B单质的元素为Mg元素,原子核外有3个电子层,最外层电子数为2,则应位于周期表第三周期ⅡA族,C为Na2O2,为离子化合物,电子式为 ,
,
故答案为:第三周期ⅡA族; ;
;
(2)J为H2O,水分子之间存在氢键且比硒化氢的分子间作用力强,故其沸点比硒化氢(H2Se)的沸点高,
故答案为:水分子之间存在氢键且比硒化氢的分子间作用力强;
(3)由题意可知,NH3在O2中点燃生成N2和H2O,则反应的化学方程式为4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,
故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O;
(4)D与足量的N反应生成E和F的化学方程式为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3,
故答案为:Mg3N2+8HNO3=3Mg(NO3)2+2NH4NO3;
(5)硝酸与铜反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(6)上图中,在同一反应里一种物质既作氧化剂,又作还原剂反应有:2Na2O2+2H2O=4NaOH+O2↑,3NO2+H2O=2HNO3+NO,共2个反应,故答案为:2.
点评 本题考查无机物的推断,题目难度中等,本题中的几个突破口:①B与冷水缓慢反应,与沸水迅速反应,放出氢气,②D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱,③C为淡黄色固体化合物,④蓝色沉淀,再结合转化关系推断,需要学生具备扎实的基础.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2发生氧化反应 | |
| B. | 氧化性:Cr2O72->Fe3+>SO42- | |
| C. | 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA | |
| D. | 若6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸在该反应中起酸性和氧化性作用 | |
| B. | 生成0.5molSe,转移电子数为2NA | |
| C. | I2是氧化产物 | |
| D. | 氧化剂和还原剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
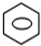 +HNO3(浓)$→_{55℃-60℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃-60℃}^{浓硫酸}$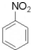 +H2O
+H2O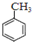 )的一氯取代物共有种4,请写出其中任意两种的结构简式
)的一氯取代物共有种4,请写出其中任意两种的结构简式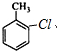 或
或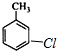 、
、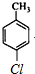 或
或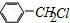 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com