
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
分析 Cu在酒精灯上灼烧生成CuO,CuO是碱性氧化物,能和酸、氢气、CO、乙醇发生反应,将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少,说明生成的CuO能溶于溶液中生成离子,据此分析解答.
解答 解:Cu在酒精灯上灼烧生成CuO,CuO是碱性氧化物,能和酸、氢气、CO、乙醇发生反应,将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少,说明生成的CuO能溶于溶液中生成离子,
A.CuO和稀盐酸反应方程式为CuO+2HCl=CuCl2+H2O,所以最终铜质量减少,故A正确;
B.CuO和乙醇反应方程式为CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+H2O,最终铜片质量不变,故B错误;
C.CuO和石灰水不反应,所以最终铜片质量增大,故C错误;
D.氢气和CuO反应方程式为CuO+H2$\frac{\underline{\;△\;}}{\;}$Cu+H2O,最终铜片质量不变,故D错误;
故选A.
点评 本题以Cu为载体考查物质之间的反应,明确物质性质是解本题关键,注意CuO和乙醇的反应中Cu作催化剂,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 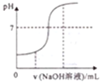 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 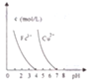 pH=7时,Cu2+、Fe3+都能沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
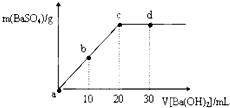
| A. | 硫酸溶液的体积为30 mL | |
| B. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 | |
| C. | d时刻溶液的pH约为13 | |
| D. | 溶液的导电能力:c<d=b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com