
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| C. | 镀层破损后,镀锡铁片比镀锌铁片更耐腐蚀 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
分析 A.晶体管材料应具有导电性;
B.石油催化裂化的目的是提高汽油等轻质油的产量与质量;
C.镀锌铁中Fe作负极被腐蚀,作正极被保护;
D.乙醇使蛋白质变性.
解答 解:A.晶体管材料应具有导电性,锗电子迁移率比硅强,可用于半导体材料,故A正确;
B.石油催化裂化的目的是提高汽油等轻质油的产量与质量,裂解的目的是得到小分子的烯烃,故B错误;
C.Zn的活泼性比Fe强,所以构成原电池时Fe作正极被保护;Sn的活泼性比Fe弱,构成原电池时,Fe作负极被腐蚀,所以镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀,故C错误;
D.乙醇消毒液消毒是因为可以使蛋白质变性,而并非是将病毒氧化,而次氯酸钠溶液可以将病毒氧化而达到消毒的目的,故D错误.
故选A.
点评 本题考查半导体的性质、石油加工、原电池、蛋白质的变性等知识,难度不大,熟悉相关物质的性质是解题关键.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

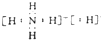 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
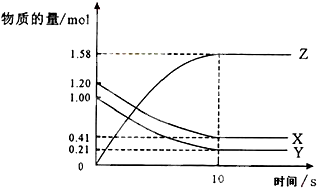 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应进行到第10S时,该反应就达到了平衡状态 | |
| B. | 前10S,用Z表示的反应速率为0.158 mol/(L•S) | |
| C. | 反应进行到第8S时,反应速率v(Z)>v(X)>v(Y) | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中不含有氧原子 | |
| B. | 该有机物分子中含一个氧原子 | |
| C. | 该有机物一个分子中含2个氧原子 | |
| D. | 不能确定该有机物分子中是否含有氧原子及其个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制溴苯时,将导气管插入水中使其充分吸收尾气 | |
| B. | 配制新制Cu(OH)2悬浊液:在一定量CuSO4溶液中,滴加少量NaOH溶液 | |
| C. | 只用溴水一种试剂可鉴别出甲苯、己烯、乙醇、四氯化碳四种液体 | |
| D. | 制取乙酸乙酯实验中,在一定量乙醇中,依次加入0.5mol/L的H2SO4和乙酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com