
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
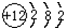 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;分析 (1)同周期从左到右非金属性增强,同主族从上到下非金属性减弱;
(2)稀有气体的性质最不活泼;
(3)同周期从左到右,原子半径随着原子序数的增大而减小;
(4)某原子结构示意图为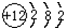 ,该原子含有12个质子,原子序数为12;
,该原子含有12个质子,原子序数为12;
(5)S的正化合价为+4、+6价;
(6)元素的非金属性越强,其氢化物越稳定;
(7)同周期从左到右,氢氧化物的碱性减弱;能和强酸、强碱反应生成盐和水的氢氧化物是两性氢氧化物;
(8)根据图片知,该氮的氢化物是氨气;N2H4中N元素和H元素的质量比等于其相对原子质量与原子个数之积的比.
解答 解:(1)同周期从左到右非金属性增强,同主族从上到下非金属性减弱,所以几种元素中非金属性最强的是F,
故答案为:F;
(2)稀有气体的性质最不活泼,则单质的化学性质最不活沷的元素是Ar,
故答案为:Ar;
(3)同周期从左到右,原子半径随着原子序数的增大而减小,所以C原子半径大于O,故答案为:C;
(4)某原子结构示意图为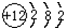 ,该原子含有12个质子,原子序数为12,即为Mg元素,
,该原子含有12个质子,原子序数为12,即为Mg元素,
故答案为:Mg;
(5)S的正化合价为+4、+6价,所以S的氧化物是SO2和SO3;故答案为:SO3;
(6)元素的非金属性越强,其氢化物越稳定,Cl的非金属性大于S,所以H2S和HCl中,热稳定性较强的是HCl,故答案为:HCl;
(7)同周期从左到右,氢氧化物的碱性减弱,则NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是NaOH;能和强酸、强碱反应生成盐和水的氢氧化物是两性氢氧化物,则属于两性氢氧化物的是Al(OH)3;
故答案为:NaOH;Al(OH)3;
(8)根据图片知,该分子中含有1个N原子和3个H原子,所以该氮的氢化物是氨气,其化学式为NH3;NH3溶于水生成一水合氨,溶液显碱性;N2H4中N元素和H元素的质量=$\frac{14×2}{1×4}$=7:1;
故答案为:NH3;碱性;7:1.
点评 本题考查了元素周期表和元素周期律的综合应用,明确元素周期律的内涵是解本题关键,根据元素周期律结合物质结构、基本概念来分析解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
 向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
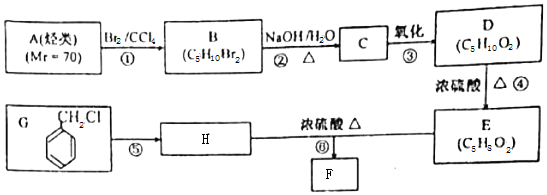
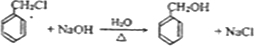 .
. .
.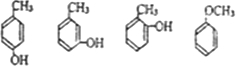 写出其中一种.
写出其中一种.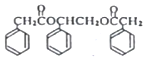 .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)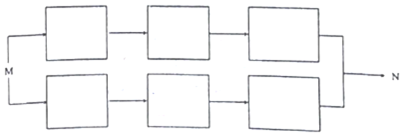
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、Cl-、I- | B. | Cu2+、Na+、Cl-、NO3- | ||
| C. | K+、HCO3-、OH-、Ba2+ | D. | K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 用50 mL 0.55 mol•L-1的NaOH溶液与60 mL 0.50 mol•L-1的盐酸反应,测得的中和热数值偏大 | |
| D. | 使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com