
【题目】南海是一个巨大的资源宝库,开发利用海水资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是 ( )

A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D.溴工业中③、④的目的是富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 开启啤酒瓶盖,瓶中立即泛起大量泡沫
B. 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
C. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
D. 在pH等于3的醋酸溶液中加入少量CH3COONa,溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
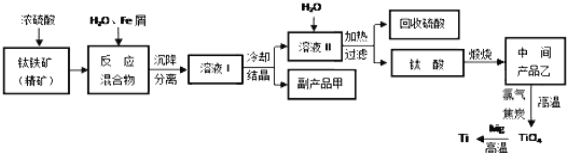
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
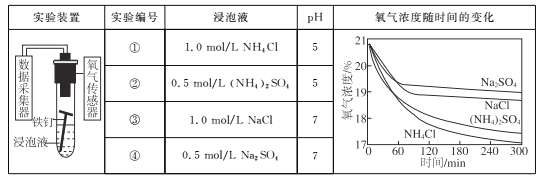
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2H→H2放出437.6 kJ的热量,下列说法正确的是_______
A. 氢气分子内每个氢原子都达到稳定结构
B. 氢气分子的能量比两个氢原子的能量低
C. 1 mol H2 离解成 2 mol H 要放出437.6 kJ热量
D. 氢原子比氢气分子稳定
(2)已知原电池的总反应式:Cu + 2FeCl3 = CuCl2 + 2FeCl2,请写出电极反应方程式:
负极___________________________________
正极___________________________________
(3)如图所示,在锥形瓶放置装有水的小试管,往小试管中分别加入下列物质:①烧碱固体 ②浓硫酸 ③硝酸铵固体④NaCl固体,其中能使a端液面高于b端液面的是_______________。(填序号)

(4)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O![]() 2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
2H2↑+O2↑。制得的氢气可用于制作燃料电池.试回答下列问题:
①分解海水时,实现了光能转化为______能;生成的氢气用于制作燃料电池时,实现了化学能转化为______能;分解海水的反应属于______反应(填“放热”或“吸热”)。
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为:2H2 + 2O24e=2H2O,则A极是电池的______极,电子从该极______(填“流入”或“流出”),B极的电极反应式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
CO2(g) +4H2(g) ![]() CH4(g) + 2H2O(g) ΔH= a kJ/mol
CH4(g) + 2H2O(g) ΔH= a kJ/mol
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol.
②CH4(g) + 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol.
请回答:①②这两个反应在热力学上趋势均很大,其原因是__________________; a=____________kJ/mol。
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=______MPa-2。(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有__________。
A.通入惰性气体 B.提高温度
C.增加二氧化碳浓度 D.增加氢气浓度

③下列说法正确的是_________。
A.平衡常数大小:KN>KM
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.当压强或n( H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
①该电池的负极是___________(填a或b),②负极电极反应式为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图甲表示在此反应过程中的能量的变化,图乙表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图丙表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )
A.升高温度,该反应的平衡常数增大
B.由图乙信息,从11 min起其他条件不变,压缩容器的体积,则n(N2)的变化曲线为d
C.由图乙信息,10 min内该反应的平均速度v(H2) = 0. 09 mol·L-l·min-l
D.图丙中温度T1 < T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用a mol/L的盐酸滴定未知浓度的氢氧化钠溶液,用酚酞作指示剂,达到滴定终点的现象是___。
(2)硫代硫酸钠晶体(Na2S2O3.5H2O,M=248g/mol)可用作定影剂、还原剂。回答下列问题:
利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,配成100ml溶液 ②滴定:取0.0090mol/LK2Cr2O7的标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应K2Cr2O+6KI+7H2SO=Cr2(SO)+7H2O+3I+4K2SO,然后用硫代硫酸钠样品溶液滴定,发生反应:2Na2S2O3+I2=Na2S4O6+2NaI。加入淀粉溶液作为指示剂,继续滴定,到终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为___(保留1位小数)。
(3)已知:常温下,醋酸的电离平衡常数为1×10-6,则0.01mol/L的醋酸钠溶液的pH=___,水电离出的c(H+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界________。

(2)元素甲是第三周期ⅥA族元素,请在方框中按氦元素的式样(如图)

写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
____
(3)元素乙的M层上有3个电子,则乙原子半径与甲原子半径比较:________>________(用元素符号表示),甲、乙的最高价氧化物水化物相互反应的离子方程式为:________
(4)元素周期表体现了元素周期律,即元素的性质随着_________的递增呈现____的变化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com