


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
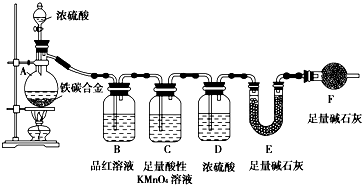 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置:| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、7CH4(g)+3O2(g)+H2O(g)=7CO(g)+15H2(g) |
| B、5CH4(g)+2O2(g)+H2O(g)=5CO(g)+11H2(g) |
| C、4CH4(g)+O2(g)+2H2O(g)=4CO(g)+10H2(g) |
| D、3CH4(g)+O2(g)+H2O(g)=3CO(g)+7H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2COOCH2CH(CH3)2 |
| B、CH3 COOCH(CH3)2 |
| C、CH3 COOCH2CH2CH2OOCCH3 |
| D、CH3 COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 |
| B、向2%的硝酸银溶液中滴入2%的稀氨水液直到生成的沉淀恰好溶解为止 |
| C、可采用水浴加热,也可直接加热 |
| D、可用稀硝酸洗去试管内的银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
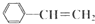 ,它可能具有的性质是( )
,它可能具有的性质是( )| A、能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
| B、与足量氢气反应生成苯乙烷 |
C、能发生加聚反应,生成物可用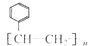 表示 表示 |
| D、易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com