
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是 ()

A. 气态氢化物的稳定性:H2O>NH3
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 如图所示实验可证明元素的非金属性:Cl>C>Si
D. 人工合成的第118号元素在周期表中位于第七周期0族
【答案】C
【解析】A.非金属性越强,其氢化物越稳定,同周期从左到右非金属性增强;B.氢与钠形成氢化钠为离子化合物,氢与氧形成水,为共价化合物;C.该实验能够证明酸性:HCl>H2CO3 >H2SiO3,但盐酸不是氯元素的最高价氧化物对应的水化物,因此不能比较元素的非金属性强弱;D.根据0族元素的原子序数变化规律,即可推断出该元素在周期表中的位置。
非金属性:O>N,非金属性越强,其气态氢化物的稳定性越强,因此稳定性:H2O>NH3,A正确;氢元素可与非金属元素形成共价化合物,如H2O,也可与金属元素形成离子化合物,如NaH,B正确;元素的最高价氧化物的水化物酸性越强,元素的非金属性越强。由实验可知酸性:HCl>H2CO3>H2SiO3,但盐酸不是氯元素的最高价氧化物对应的水化物,因此不能比较元素的非金属性强弱,C错误。根据元素周期表可知:从上往下,0族元素的原子序数依次为:2,10,18,36,54,86,118,则第118号元素位于第七周期0族,D正确;正确选项C。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】I.某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)的关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c(A)/mol·L-1 | 1.45 | 1.28 | 1.00 | 1.00 |
c(B)/mol·L-1 | 0.38 | 0.72 | 1.28 | 1.28 |
c(C)/mol·L-1 | 0.095 | 0.18 | 0.32 | 0.32 |
(1) 该反应的化学方程式为 __________________________________
(2)4 min末A的转化率约为______________
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的形态 | 反应温度/℃ | 收集100 mL氢气所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
(3)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响。
(4)实验Ⅰ和Ⅱ表明________,化学反应速率越大。
(5)能表明固体的表面积对反应速率有影响的实验编号是________和________。
(6)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的结构示意图为 ,试回答:
,试回答:
(1)x表示____________,y表示____________。
(2)当x-y > 10时,该微粒是________(选填“阳离子”或“阴离子”或“原子”)
(3)当![]() 时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
(4)当y=2的中性原子M跟y=7的中性原子N化合时,形成化合物的化学式为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的铬渣含有SiO2、A12O3、Fe2O3、Na2Cr2O7(易溶于水,是强氧化剂)等,处理建议是将+6价铬转化为低毒性的+3价铬后制备K2Cr2O7。实验室模拟处理铬渣的工艺流程如下(部分操作和条件略):

(1)已知过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
2CrO42-(黄色)+2H+,则滤液应呈现的颜色是_________
(2)滤渣1的成分为______ 滤渣2中所含的金属元素为___________
(3)根据表中生成成氧化物沉淀的pH数据判断,流程中a的范围为__________。
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 |
开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 |
完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 |
(4)过滤3所得滤液又回流到过滤1所得滤液中,其目的是__________
(5)由Cr(OH)3得到黄色溶液过程中发生的反应的离子方程式是_________
(6)向橙色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_________,用平衡移动的原理解释溶液pH变小的原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: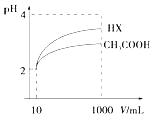
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( )
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.
2ClO2↑+K2SO4+2CO2↑+2H2O.
下列说法中错误的是( )
A.KClO3在反应中得到电子
B.ClO2中氯的化合价为+4价
C.在反应中H2C2O4是还原剂
D.1 mol KClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是

选项 | ① | ② | 现象 |
A | 淀粉KI溶液 | 浓硫酸 | 溶液变蓝 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
D | 浓盐酸 | 浓氨水 | 有白烟产生 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类的生理作用的叙述中,不正确的是 ( )
A.核糖和脱氧核糖是核酸的组成成分
B.葡萄糖是细胞的主要能源物质
C.纤维素是植物细胞壁的主要成分
D.糖原是植物细胞中重要的储存能量的物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com