
| A. | 因为C和Si是同主族元素,故CO2和SiO2形成的晶体相同 | |
| B. | 在晶体中有阳离子就一定有阴离子 | |
| C. | 由于水分子间可以形成氢键故水分子的稳定性很强 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
分析 A.二氧化碳为分子晶体,二氧化硅为原子晶体;
B.金属晶体是由金属阳离子和自由电子构成的;
C.分子的稳定性与共价键有关;
D.存在离子键的晶体为离子晶体.
解答 解:A.二氧化碳晶体中分子间以分子间作用力结合形成分子晶体,二氧化硅中原子间通过共价键形成空间网状结构为原子晶体,二者晶体类型不同,故A错误;
B.金属晶体是由金属阳离子和自由电子构成的,所以含有阳离子的晶体不一定含有阴离子,故B错误;
C.分子的稳定性与共价键有关,共价键键能越大,分子越稳定,与氢键无关,故C错误;
D.存在离子键的晶体为离子晶体,所以分子晶体中一定不含有离子键,离子晶体中可能含有共价键,如NaOH属于离子晶体含有共价键,故D正确.
故选D.
点评 本题考查了化学键、氢键、分子间作用力、晶体的类型等,题目难度不大,注意分子的稳定性与共价键有关,与氢键无关,氢键决定分子的物理性质.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层则从上口倒出 | |
| C. | 萃取、分液前需对分液漏斗进行检漏 | |
| D. | 选用酒精萃取碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | ⑦⑧ | C. | ①③⑤⑥⑦ | D. | ①③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在正极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、甲苯、溴乙烷(酸性高锰酸钾溶液) | B. | 乙醇、乙醛、乙酸(新制Cu(OH)2) | ||
| C. | 苯、乙醇、四氯化碳(溴水) | D. | 苯、己烷、苯酚溶液(浓溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的漂白原理与次氯酸相同 | B. | 硫在足量空气中燃烧生成大量SO3 | ||
| C. | 浓硫酸可以干燥H2、H2S、CO2等气体 | D. | 可用铝槽储运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原子半径:Br>Se | |
| B. | 还原性:H2Se>HBr | |
| C. | Se在元素周期表中位于第四周期第六族 | |
| D. | 在Se2Br2分子中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molNa2CO3的溶液中CO32-的微粒数目 | |
| B. | 常温常压下,22.4 L N2的原子数目 | |
| C. | 46gNO2和N2O4的混合气体中的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
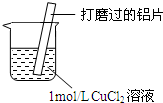 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com