
|
根据下列物质中硫的化合价判断,下列说法中错误的是 | |
| [ ] | |
A. |
H2SO4具有氧化性 |
B. |
H2SO4具有还原性 |
C. |
H2S具有还原性 |
D. |
S既有还原性,又有氧化性 |
科目:高中化学 来源: 题型:
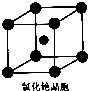 《物质结构与性质》
《物质结构与性质》

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
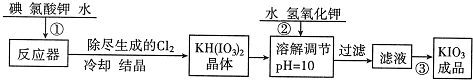
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 1270 |
| 3w |
| 423.33 |
| w |
| 1270 |
| 3w |
| 423.33 |
| w |
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
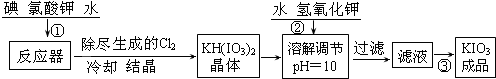
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
| 操 作 步 骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
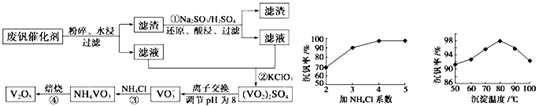
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
+ 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
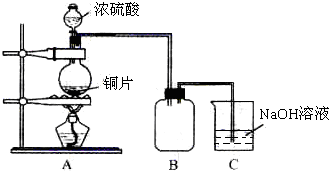
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com