
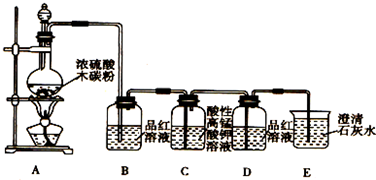
分析 (1)碳和浓硫酸在加热条件下反应生成SO2和CO2、水.
(2)SO2具有漂白性,可以使品红溶液褪色,因此常用品红溶液检验SO2;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净;
(4)装置D中品红溶液不褪色,说明SO2除干净;
(5)装置E中澄清的石灰水变浑浊,说明产物中一定存在CO2气体,CO2和氢氧化钙反应生成碳酸钙沉淀.
解答 解:(1)碳和浓硫酸在加热条件下反应生成SO2和CO2、水,其反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)SO2具有漂白性,可以使品红溶液褪色,常用品红溶液检验SO2,因此装置B中品红溶液用于检验产物SO2,
故答案为:品红褪色;SO2;漂白性;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液吸收SO2,表现了二氧化硫的还原性,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,
故答案为:还原性;甲;
(4)SO2具有漂白性,可以使品红溶液褪色,装置D中品红溶液不褪色,说明SO2除干净,
故答案为:已除尽;
(5)装置E中澄清的石灰水变浑浊,说明产物中一定存在CO2气体,CO2和氢氧化钙反应生成碳酸钙沉淀,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:澄清石灰水变浑浊; CO2;CO2+Ca(OH)2=CaCO3↓+H2O.
点评 本题考查了浓硫酸的强氧化性、SO2和CO2性质的比较,注意SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,有利于培养学生的良好的科学素养,提高学生学习实验的积极性,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
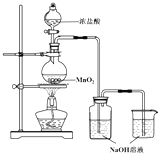 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com