
����Ŀ�����й����Ȼ�ѧ��Ӧ����������ȷ������ ��
A��HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ/mol��
��H2SO4��Ca(OH)2��Ӧ���к��ȡ�H=2��(-57��3)kJ/mol
B��CO�ı�ȼ�����ǡ�H=-283��0KJ/mol��
��ӦCO(g)+![]() O2(g)�TCO2(g)�ġ�H=��283��0KJ/mol
O2(g)�TCO2(g)�ġ�H=��283��0KJ/mol
C����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D��1 mol��ȼ��������̬�����������ų�����������Ƶ�ȼ����
���𰸡�B
��������H2SO4��Ca(OH)2��Ӧ����������ˮ������������Ƴ������ų��������������H2SO4��Ca(OH)2��Ӧ���к��ȡ�H��2��(-57.3)kJ/mol����A����ȼ������ָ1mol��ȼ����ȫȼ�������ȶ�������ų����������Ȼ�ѧ����ʽ�ı䷽��Ӧ�ʱ������֮�仯��ϵ���ӱ��ʱ���֮�ӱ���CO�ı�ȼ�����ǡ�H=-283.0KJ/mol��CO(g)+![]() O2(g)=CO2(g)��H=
O2(g)=CO2(g)��H=
��283.0KJ/mol/mol����B��ȷ�����ȷ�Ӧ��һ�������ȷ�Ӧ��ijЩ���ȷ�ӦҲ��Ҫ���������������ȷ�Ӧ�Ƿ��ȷ�Ӧ������Ҫ�����������Ȳ��ܽ��У���C����D������ȫȼ��ֻ�����ɶ����������岻�����������������壬��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʫ�������ϵ���˿����������ɻ���ʼ��������˿�����������ֱ����ڣ� ��
A. ��ά�ء���֬ B. �����ʡ�����
C. ���ۡ���֬ D. �����ʡ�Ӳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȡ���ҵ����������(Al2O3��Fe2O3)Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������¡�
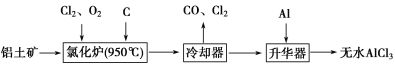
��1���Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ ��
��2����Na2SO3��Һ�ɳ�ȥ��ȴ���ų���β���е�Cl2���˷�Ӧ�����ӷ���ʽΪ ��
��3������������Ҫ����AlCl3��FeCl3�����������Al���������� ��
��4��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ(������FeCl3)�Ĵ��ȣ���ȡ16.25 g��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�У����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ���������Ϊ0.32 g��
��д���������ӹ������漰�����ӷ���ʽ��
��AlCl3��Ʒ�Ĵ���Ϊ
��5����ҵ����һ��������Ϊԭ���Ʊ���ˮAlCl3�Ĺ����У����һ������AlCl3��6H2O��ˮ�Ʊ���ˮAlCl3��ʵ����һ���ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�е�NH4+���������£�

��1��������NH4+ת��ΪNO3-��NO2-����ҺpH__________�����������С���� �����䡱����
��2�����ݽ��µ��о���������ֻ��NO2-����ˮ�뺬NH4+����ˮ��������ϣ�ֱ��ת��Ϊ�����壬������Ϊ_________���˷������ŵ���__________��
��3����ȫ������1mol NH4+��ˮ����n(O2)��n(CH3OH)��ϵʽΪ___________[��n(O2)��n(CH3OH)��ʾ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Tl)�����軯��(KCN)����ΪA��Σ��Ʒ����֪���з�Ӧ��һ���������ܹ�������
(1)Tl3����2Ag��Tl����2Ag��
(2)Ag����Fe2����Ag��Fe3��
(3)Fe��2Fe3����3Fe2����
�������������ԱȽ�˳����ȷ����( )
A��Tl3����Fe3����Ag�� B��Fe3����Ag����Tl3��
C��Tl����Ag����Fe2�� D��Tl3����Ag����Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڴ���H+��Br-��Ca2+����Һ�л������������� ��
A��OH- B��Ag+ C��CO32- D��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2=-58 kJ/mol
CH3OH(g)+H2O(g) ��H2=-58 kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H3=+41 kJ/mol
CO(g)+H2O(g) ��H3=+41 kJ/mol
�ش��������⣺
��1��CO2�ĵ���ʽ�� ��
��2����H1= kJ/mol������Ӧ������ر���S 0(�������)��
��3�����ݻ�Ϊ2L���ܱ������У�����һ����CO2��H2�ϳɼ״�(��������Ӧ)����������������ʱ���¶�T1��T2�Է�Ӧ��Ӱ��ͼ����ͼ������˵����ȷ����__________(�����)
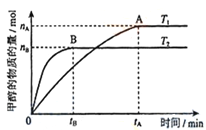
���¶�ΪT1ʱ���ӷ�Ӧ��ƽ�⣬���ɼ״���ƽ������Ϊ��v(CH3OH)=nA/tA mol/(L��min)
����v(CH3OH) = v(H2O)ʱ��˵����Ӧ�ﵽƽ��
����������ƽ����Է�������A�����B��
������A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱn(H2)��n(CH3OH)��ֵ����
��4����T1�¶�ʱ����2molCO2��6molH2����2L�ܱ������У���ַ�Ӧ(��������Ӧ)�ﵽƽ�����CO2ת����Ϊ50%�����������ڵ�ѹǿ����ʼѹǿ֮��Ϊ__________��T1�¶ȣ���ӦCH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)��ƽ�ⳣ����ֵΪ__________��
CO2(g)+3H2(g)��ƽ�ⳣ����ֵΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.12g���ۼ���25mL 2molL��1���Ȼ�����Һ�У���ַ�Ӧ�������ǣ� ��
A. ����ʣ�࣬��Һ��dz��ɫ��Cl��Ũ�Ȼ�������
B. ����Һ�е�����ɫKSCN��Һ���Ի�ɫ
C. Fe2+��Fe3+�����ʵ���֮��Ϊ6��1
D. ���������뻹ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��Ӧ���ʵĸ���������( )
A. �¶Ⱥ�ѹǿ B. ��Ӧ���Ũ��
C. �μӷ�Ӧ�ĸ����ʵ����� D. �����ļ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com